Определение соотношения белок-креатинин в моче используется для количественной оценки степени протеинурии при условии, что в осадке мочи отсутствуют признаки воспаления или значительной гематурии (особенно гемоглобинурии), а также для установления связи патологического процесса с заболеванием почек.
Моча здорового животного должна содержать мало белка по сравнению с уровнем креатинина, поскольку белки, фильтруемые через клубочки, почти полностью реабсорбируются в проксимальных почечных канальцах. Таким образом, низкие значения соотношения белка к креатинину считаются нормальными.
Появление белка в моче может быть связано с дисфункцией сосудистого эндотелия почечных клубочков, например, при клубочковой гипертензии и гиперперфузии. В таком случае обычно отмечается незначительное повышение количества белка в моче. Более значительная потеря белка через почки происходит при структурном повреждении клубочков. К потере белка с мочой также приводят нарушения функции эпителия почечных канальцев.
Количество белка, потерянного с мочой, связано с количеством креатинина в моче. Общая суточная экскреция креатинина в основном зависит от мышечной массы и, следовательно, относительно постоянна у отдельно взятого пациента. В связи с тем, что у собак и кошек практически отсутствует канальцевая реабсорбция креатинина, экскреция данного вещества стабильна. Поскольку степень протеинурии в разовой порции мочи зависит от уровня гидратации пациента, то для более точной оценки вводится поправка на креатинин с целью коррекции изменений, связанных с колебаниями относительной плотности мочи.
Как правило, мониторинг соотношения UP/UC представляет наибольший интерес, когда протеинурия обусловлена заболеваниями почечных клубочков. Такие заболевания приводят к изменению клубочковой проницаемости и могут быть вызваны гломерулонефритом (обычно иммуноопосредованным), амилоидозом, гломерулосклерозом или наследственной нефропатией. При мониторинге пациентов важно пользоваться услугами одной лаборатории, чтобы свести к минимуму аналитическую вариацию.
Причины повышения значения UP/UC можно разделить на три категории:
1) Преренальная протеинурия, возникающая в результате превышения реабсорбтивной способности канальцев, при усиленной фильтрации фрагментов иммуноглобулинов, свободного гемоглобина или миоглобина.
2) Почечная протеинурия, причиной которой являются первичные заболевания клубочкового аппарата почек, такие как гломерулонефрит и амилоидоз, интерстициальный нефрит, тубулярные повреждения, а также функциональная протеинурия (изменения физиологии почек без их поражения, например, в результате физического переутомления, чрезмерного термического воздействия, развития лихорадочного состояния, судорог, венозного застоя).
Первичные гломерулярные заболевания могут быть причиной значительной протеинурии (соотношение UP/UC часто больше 3, и обычно больше 5). Основным белковым компонентом в моче является альбумин. У собак с амилоидозом обычно отмечается более высокий коэффициент UP/UC (более 18), чем при гломерулонефрите (от 5 до 15). Первичные заболевания канальцевой системы почек вызывают протеинурию от легкой до умеренной степени. Соотношение UP/UC составляет менее 3. Основными белковыми компонентами мочи являются глобулины с низкой молекулярной массой. Ренальная протеинурия, как правило, ассоциируется с заболеваниями клубочковой системы и канальцев. Отсутствие протеинурии не исключает тяжелого заболевания почек, особенно при болезнях, не затрагивающих клубочковый аппарат.
3) Постренальная протеинуриия, в результате развития кровотечения или экссудативных процессов в почечной лоханке, мочеточниках, мочевом пузыре, уретре и/или половых путях.
Определение белка и креатинина должны выполняться с использованием одного образца мочи.
Для исследования рекомендуется использовать разовую порцию мочи, полученную путем цистоцентеза или катетеризации мочевого пузыря. Образец при помощи шприца переносят в транспортную пробирку. Образец стабилен в течение двух дней при температуре хранения +2ºС…+8ºС.
Результаты исследования содержат информацию исключительно для врачей. Диагноз ставится на основании комплексной оценки различных показателей, дополнительных сведений и зависит от методов диагностики.
Референсные значения:
Собаки: 100 лейкоцитов или имеет место значительная гематурия, так как это может привести к повышению уровня общего белка в моче и привести к получению ложнозавышенного результата. Гематурия, выявленная при микроскопии осадка мочи, оказывает небольшое влияние на результат, и только значительная гематурия приводит к существенному изменению исследуемого соотношения.
Причины повышения уровня:
- Преренальные:
Внутрисосудистый гемолиз (иммунообусловленная гемолитическая болезнь, токсическое действие цинка, пироплазмоз, введение гипотонической жидкости).
Неоплазия (миелома, В-клеточная лимфома, лейкемия).
Рабдомиолиз.
- Ренальные:
• Гломерулонефрит: мембранозный, мезангиопролиферативный или мезангиокапиллярный.
•Иммунноопосредованный: идиопатический, неоплазия (например, лимфома, мастоцитоз, лейкозы, первичный эритроцитоз), бактериальный (например, хроническая пиодермия, пиометра, сепсис, бруцеллез, боррелиоз), риккетсиозный (например, эрлихиоз), паразитарный (например, дирофиляриоз, лейшманиоз, пироплазмоз, трипаносомоз), вызванный панкреатитом, вирусными заболеваниями (например, FeLV, FIP, вирусом инфекционного гепатита собак) или аутоиммунными заболеваниями (например, системной красной волчанкой)
Эндокринные: гиперадренокортицизм.
• Инфекционный: вирусныйгепатитсобак.
• Кожная и почечная клубочковая васкулопатия борзых собак.
• Действие лекарственных препаратов: сульфадиазина у доберманов.
• Амилоидоз: реактивный (вторичный) при хронических системных воспалительных заболеваниях, при миеломе.
• Гломерулосклероз: сахарный диабет, системная гипертензия, идиопатическая или терминальнальная стадия гломерулярных заболеваний.
• Наследственная гломерулопатия.
• Тубулоинтерстициальный острый или хронический нефрит: лептоспироз, вирусный гепатит собак, FIP или грибковое поражение.
• Канальцевый некроз: гипоксия, действие лекарственных препаратов (аминогликозидов) или этиленгликоля.
• Пиелонефрит.
• Неоплазия: лимфома или рак почки.
• Трубулярные дефекты: приобретенные или наследственные (синдром Фанкони).
• Паразитирование Dioctophyma renale.
• Функциональная (редко встречается в ветеринарной практике)
• Действие экстремальных температур.
• Венозный застой.
• Физическое переутомление.
• Судороги.
• Лихорадочное состояние.
• Цистит: бактериальный, идиопатический (у кошек), грибковый (Aspergillus, Candida) или токсический (циклофосфамид).
• Кровотечение: травма или коагулопатия.
• Неоплазия: переходно-клеточный рак.
• Пиелит.
• Уретерит.
• Мочекаменнаяболезнь.
• Заболевания генитального тракта или нормальные выделения половых путей могут повлиять на результаты исследования.
Понижение уровня:
Не имеет диагностической значимости.
источник
Определение соотношения в моче белка к креатинину – эталон ранней диагностики болезней почек.
Определение концентрации белка в моче является обязательным и важным элементом исследования мочи.
Выявление и количественная оценка протеинурии важна не только в диагностике многих первичных и вторичных заболеваний почек, оценка изменения выраженности протеинурии в динамике несет информацию о течении патологического процесса, об эффективности проводимого лечения. Обнаружение белка в моче даже в следовых количествах должно настораживать в отношении возможного заболевания почек или мочевых путей и требует повторного анализа.
Появление белка в моче является предвестником почечной недостаточности. Данное явление также называется протеинурия. Поступление белка с более высокой молекулярной массой в мочу обуславливается повреждением базальной мембраны почек. Одновременно с этим низкомолекулярные соединения (в том числе и креатинин) ещё фильтруются по-прежнему, и их концентрация в моче и крови не меняется.
Повышенное содержание белка в моче указывает на патологию почек. Это ранний показатель повреждения нефронов при отсутствии сопутствующих изменений уровня мочевины и креатинина, определяемых классически в сыворотке крови. Причинами повреждения могут быть лекарственные средства (аминогликозиды, циклоспорин), тяжёлые металлы (свинец), анальгетики, ишемия почек, перенесенные болезни и метаболические заболевания. Расширить диагностику протеинурии можно, определив соотношение белка и креатинина в моче. Данное исследование намного объективно и применяется для определения тяжести протеинурии.
В настоящее время для определения белка в моче все чаще используются диагностические полоски. Это качественный и полуколичественный метод. О содержании белка в моче судят по интенсивности сине-зеленой окраски, развивающейся после контакта реакционной зоны с мочой. Результат оценивается визуально или с помощью анализаторов мочи. Несмотря на большую популярность и очевидные преимущества методов сухой химии (простота, скорость выполнения анализа) данные методы анализа мочи в целом и определения белка в частности не лишены серьезных недостатков. Одним из них, приводящих к искажению диагностической информации, является большая чувствительность индикатора к альбумину по сравнению с другими белками. В связи с этим, тест-полоски в основном приспособлены к обнаружению селективной гломерулярной протеинурии, когда практически весь белок мочи представлен альбумином. При прогрессировании изменений и переходе селективной гломерулярной протеинурии в неселективную (появление в моче глобулинов) результаты определения белка оказываются заниженными по сравнению с истинными значениями. Данный факт не дает возможности использовать данный метод определения белка в моче для оценки состояния почек (гломерулярного фильтра) в динамике. При тубулярной протеинурии результаты определения белка также оказываются заниженными. Определение белка с помощью диагностических полосок не является надежным индикатором низких уровней протеинурии (большинство выпускаемых в настоящее время диагностических полосок не обладают способностью улавливать белок в моче в концентрации ниже, чем 0,15 г/л). Отрицательные результаты определения белка на полосках не исключают присутствия в моче глобулинов, гемоглобина, уромукоида, белка Бенс-Джонса и других парапротеинов.
Хлопья слизи с высоким содержанием гликопротеидов (например, при воспалительных процессах в мочевых путях, пиурии, бактериурии) могут оседать на индикаторной зоне полоски и приводить к ложноположительным результатам. Ложноположительные результаты могут также быть связаны с высокой концентрацией мочевины. Плохое освещение и нарушение цветоощущения может быть причиной неточного результата.
В связи с этим, использование диагностических полосок следует ограничить для скрининговых первичных процедур, а результаты, полученные с их помощью, следует рассматривать лишь как ориентировочные.
Наиболее чувствительными и точными являются колориметрические методы определения общего белка мочи, основанные на специфических цветных реакциях белков. Данное исследование проводится на биохимическом анализаторе, что обуславливает большую точность проводимого исследования и позволяет определить абсолютное значение содержания белка в моче.
Учитывая выраженные колебания уровня протеинурии в различное время суток, рекомендуется определять в разовой порции мочи концентрации белка и креатинина. Поскольку скорость выделения креатинина в течение дня достаточно постоянна и не зависит от изменения скорости мочеотделения, отношение концентрации белка к концентрации креатинина постоянно. Данное отношение хорошо коррелирует с суточной экскрецией белка и, следовательно, может использоваться для оценки выраженности протеинурии.
Важным достоинством метода оценки выраженности протеинурии по соотношению белок/креатинин является полное исключение ошибок, связанных с невозможностью или неполным сбором суточной мочи.
Материалом для исследования является моча. Предпочтительно собрать среднюю порцию утренней мочи (достаточно 2 — 5 мл) в чистую сухую стеклянную или пластиковую посуду с плотно закручивающейся крышкой. По возможности нужно собирать мочу сразу в посуду, в которой она будет доставлена в лабораторию. Если это не удается, желательно собрать ее в чистую посуду (тарелка, банка или др.), где раньше не было мочи (так как образуется осадок из фосфатов, который остается даже после ополаскивания и способствует разложению свежей мочи), а затем перелить всю полученную порцию в сосуд. Лучше всего собирать мочу в специальные пластиковые стаканчики с крышками.
При невозможности доставить мочу сразу в лабораторию, ее возможно хранить при температуре 2…8*С в течение суток (если исследование не будет проводиться на другие показатели).
При невозможности сбора мочи владельцами, возможно взятие образца путем катетеризации или прокола мочевого пузыря.
Соотношение белка мочи и креатинина мочи (общий белок мг/мл : креатинин мг/мл) у собак и кошек в норме должно составлять не более 0,2.
| Соотношение белка мочи и креатинина мочи | Подтип | |
| Собаки | Кошки | |
| 0.5 | >0.4 | Протеинурия |
Пограничная протеинурия может быть обусловлена тубулярным или гломерулярным заболеваниями почек.
В случае средней или сильной персистирующей протеинурии, сопровождаемой осадком без признаков гематурии и воспаления, есть предпосылки к подозрению на гломерулонефрит или амилоидоз почек.
Получить более подробную информацию о заболеваниях почек (в т.ч. хроническая почечная «недостаточность», хроническая болезнь почек) можно у ветеринарных нефрологов нашего ветеринарного центра, а также провести биохимический анализ мочи в нашей лаборатории.
источник
Катетер-ассоциированные инфекции мочевыводящих путей (EAU)
Рекомендации EAU составлены по принципам «медицины, основанной на доказательствах». При создании Рекомендаций EAU использовались данные мета-анализов, размещенных в базе данных Pubmed, упоминаемые исследования классифицированы в соответствии с уровнями доказательности данных. Основная цель Рекомендаций заключается не в жестком и однозначном указании методов лечения и диагностики, а предоставление доступных современных консенсусных точек зрения на наиболее приемлемые методы ведения пациентов с урологическими нарушениями.
Уровни доказательности данных и категории рекомендаций
В данных обновленных рекомендациях упоминаемые исследования классифицированы в соответствии с уровнями доказательности данных, и каждая разработанная на их основе рекомендация отнесена в соответствующую категорию (Таблицы 1.1 и 1.2).
КРАТКОЕ СОДЕРЖАНИЕ И РЕКОМЕНДАЦИИ
Мочевыводящие пути являются самым частым источником нозокомиальных инфекций, особенно при наличии катетера в мочевом пузыре (IIa). Большинство катетер-ассоциированных ИМП вызываются представителями собственной кишечной микрофлоры пациента (IIb).
Ведущим фактором риска развития катетер-ассоциированной бактериурии является длительность катетеризации (IIa), при этом ежедневно колонизируется 5% пациентов. Таким образом, у большинства пациентов бактериурия разовьется уже к 30-у дню, который используется в качестве критерия, разделяющего катетеризацию на кратковременную и длительную (IIa).
Большинство эпизодов бактериурии, связанных с кратковременной катетеризацией, протекают бессимптомно и вызываются одним возбудителем (IIa). При длительности катетеризации >30 дней могут присоединяться и другие микроорганизмы.
Клиницист должен помнить о двух наиболее важных моментах: дренажная система должна оставаться закрытой и длительность катетеризации должна быть минимальной (категория А).
При установленном катетере системную антимикробную терапию бессимптомной катетер-ассоциированной бактериурии проводить не рекомендуется (категория А).
Однако имеется ряд исключений:
(а) пациенты с риском прогрессирования процесса до тяжелых инфекционных осложнений;
(b) пациенты, подвергающиеся урологическим операциям;
(с) имплантация протезов;
(d) пациенты, инфицированные штаммами возбудителей, которые обычно вызывают бактериемию (категория В);
(е) специфическая клинически манифестная инфекция (например, пиелонефрит, эпидидимит);
(f) неспецифическое заболевание с лихорадкой, предположительно обусловленное бактериемией, вызванной уропатогенами, после исключения других причин инфекции.
Антимикробная терапия должна корректироваться на основании результатов определения чувствительности выделенных возбудителей к антибиотикам. Поэтому перед назначением любого антибиотика необходимо получить порцию мочи для проведения микробиологического исследования.
При низкой вероятности развития бактериемии достаточно короткого курса лечения (5-7 дней) (категория В). При подозрении на системную инфекцию необходимо проводить более длительное лечение (категория В).
Длительный профилактический прием антибиотиков практически всегда противопоказан (категория А). Введение антибиотика в катетер не имеет никакого значения (категория А).
При назначении антибиотиков по поводу клинически манифестной катетер-ассоциированной инфекции, по возможности следует проводить культуральное исследование мочи и замену катетера. Культуральное исследование мочи следует также проводить после окончательного завершения катетеризации (категория А).
Остается спорным вопрос о том, какой режим терапии: однократное введение или короткий курс антибиотика, – следует проводить при смене или удалении катетера (категория В).
У катетеризированных пациентов без каких-либо клинических симптомов не рекомендуется рутинно проводить культуральное исследование мочи (категория С).
Медицинский персонал должен постоянно помнить о риске перекрестной передачи инфекции между катетеризированными пациентами, соблюдать правила обработки рук и пользоваться одноразовыми перчатками (категория В).
Клиницисты всегда должны рассматривать альтернативы постоянным уретральным катетерам, которые в меньшей степени предрасполагают к развитию клинически манифестных инфекций (например, надлобковые катетеры, кондомные мочеприемники, периодическая катетеризация) (категория А).
У меньшей части пациентов можно применять специальный «невозвратный клапан», позволяющий избежать использования закрытого мочеприемника. Такие пациенты фактически предпочитают удобство дренирования «по требованию» и преимущества периодического увеличения емкости мочевого пузыря на повышенный риск развития значимой инфекции.
Пациенты с уретральными катетерами, установленными в течение 5 и более лет, должны проходить ежегодный скрининг на рак мочевого пузыря (категория В).
Инфекции мочевыводящих путей (ИМП) составляют 40% от всех нозокомиальных инфекций. У большинства таких пациентов (80%) установлен постоянный катетер (1-5) (III).
В 1920-х гг. Фолей предложил использовать самоудерживающийся катетер. Однако первоначально он применялся с открытой дренажной системой, поэтому практически у всех пациентов к концу 4-го дня развивалась бактериурия. С появлением и развитием материалов из пластика и разработкой удобных мочеприемников в практику были внедрены закрытые дренажные системы. Бактериурия стала развиваться в более поздние сроки, однако по-прежнему возникала у всех пациентов после 30 дней катетеризации (1, 6, 7) (IIa, III).
Ни одного контролируемого исследования по сравнению открытых и закрытых дренажных систем никогда не проводилось. Достаточно скоро стало ясно, что не имеет смысла доказывать очевидное, и поэтому закрытые дренажные системы стали стандартом. Интересно отметить, что в последнее время наблюдается некоторое ослабление принципа закрытой дренажной системы, что связано с разработкой так называемого «невозвратного клапана» (flip valve), который позволяет пациенту периодически опорожнять мочевой пузырь через открытый катетер.
Уретральный катетер может подавлять или «обходить» некоторые защитные механизмы (например, гликозаминогликановый слой на поверхности эпителия уретры), которые в норме препятствуют или сводят к минимуму взаимодействие бактериальных клеток с эпителием и образование биопленок. У катетеризированных пациентов бактерии могут проникать в мочевыводящие пути перечисленными ниже способами.
Во время установки катетера
Это может быть следствием недостаточной обработки места введения катетера, наружного отверстия уретры и промежности. У практически здоровых лиц катетеризация обычно не имеет каких-либо последствий. Бактериурия может развиться при интермитирующей «чистой» катетеризации, когда наружное отверстие уретры недостаточно тщательно обрабатывается перед введением катетера.
Вопрос о том, дает ли такая обработка наружного отверстия мочеиспускательного канала какие-либо значимые преимущества, остается спорным, однако у госпитализированных пациентов попадание микроорганизмов во время катетеризации может оказаться решающим. По некоторым данным, до 20% пациентов колонизируются сразу после катетеризации (9, 11) (IIa, III).
Длительная катетеризация способствует образованию слизистой муфты, свободно располагающейся между стенкой катетера и слизистой оболочкой уретры. Такая муфта создает благоприятную среду для инвазии и проникновения бактерий. Считается, хотя и является спорным, что это является причиной более частого развития бактериурии у женщин (70-80%), чем у мужчин (20-30%) (13-15) (III).
У мужчин бактерии проникают преимущественно через просвет катетера и собирательную систему ретроградным путем (т.е. восходящее распространение против тока мочи). Выпускные механизмы мочеприемников часто оказываются контаминированы бактериями, поэтому их регулярное открывание, а также разъединение компонентов дренажной системы для промывания мочевого пузыря или сбора мочи могут способствовать проникновению бактерий внутрь системы.
Инфекция, связанная с биопленками
Биопленка представляет собой скопление микроорганизмов и фрагментов их нуклеиновых кислот в мукополисахаридной среде, которые вместе образуют структурированную популяцию на какой-либо твердой поверхности. Биопленки распространены повсеместно. В урологической практике они могут образовываться на катетерах, в мочеприемниках и на других инородных телах и протезах (16). Они также обнаруживаются в очагах склероза почечной ткани и в местах хронической инфекции (например, при простатите, эпидидимите) (IIb).
Биопленка состоит из 3-х слоев:
(а) связующей пленки, прикрепленной к поверхности ткани или биоматериала,
(b) основной слой,
(с) поверхностной пленки, обращенной к просвету органа или канала, в который могут высвобождаться планктонные (свободно плавающие) микроорганизмы.
Эти микроорганизмы часто происходят из субклеточных фрагментов, растущих в базальном слое (16-19) (IIb). Микроорганизмы внутри биопленок оказываются хорошо защищенными от механического воздействия потока мочи, других защитных факторов макроорганизма и действия антибиотиков. Традиционные лабораторные тесты без труда могут выявлять в моче и иногда в тканях планктонные, свободно плавающие бактерии. Однако фрагменты бактерий, находящиеся внутри структур биопленки, не растут на стандартных питательных средах (16, 17, 20-24) (IIa, III).
СПОСОБЫ КАТЕТЕРИЗАЦИИ И РИСК РАЗВИТИЯ ИМП
Бактериурия развивается у 1-5% пациентов (7, 13, 14) (III). Риск развития бактериурии повышен у женщин, пациентов с задержкой мочи, при катетеризации в родах и послеродовом периоде, при обструкции мочевыводящих путей увеличенной предстательной железой, при сахарном диабете, у ослабленных лежачих больных и пожилых людей (25) (III).
Кратковременная катетеризация может проводиться в рамках интенсивной терапии, у пациентов с нарушенным произвольным мочеиспусканием или недержанием мочи. От 15% до 25% пациентов, поступающих в стационар, могут быть катетеризированы между 2 и 4 днями госпитализации (7, 14) (III). У 10-30% из них развивается бактериурия (3, 26, 27) (IIa, III).
Большинство эпизодов бактериурии, связанной с кратковременной катетеризацией, не сопровождаются клиническими симптомами и вызываются каким-либо одним возбудителем. В 15% случаев бактериурия может носить полимикробный характер (5) (III), отражая спектр возбудителей, преобладающих в данном стационаре или внебольничной среде. Наиболее часто выделяются E. coli, P. aeruginosa, Klebsiella pneumoniae, Proteus mirabilis, Staphylococcus epidermidis, Enterococcus spp. и Candida spp. (7, 13, 14) (IIb). В большинстве случаев катетер-ассоциированная бактериурия сопровождается пиурией.
Частота развития бактериемии является очень высокой у пациентов с длительно установленными катетерами, подвергающихся эндоскопическим вмешательствам, например ТУРП (28) (IIb).
Несмотря на высокую распространенность бактериурии среди пациентов с длительно установленным катетером, клинические проявления, являющиеся следствием восходящей инфекции или бактериемии, наблюдаются редко. В длительных исследованиях показано, что ИМП являются причиной лихорадки менее чем в 10% случаев (14) (III). Учитывая это, в случае развития у катетеризированного пациента выраженной лихорадки, крайне важно исключить другие причины.
Транзиторная бессимптомная бактериемия является распространенным состоянием при первичной установке катетера или его замене у длительно катетеризированных пациентов (29) (III). Удивителен тот факт, что риск развития бактериемии при первичной установке катетера оказывается сходным, как при наличии ИМП (7%), так и при отсутствии бактериурии (8,2%) (30, 31) (IIa). Относительно низкая частота развития ИМП с лихорадкой и бактериемии может быть обусловлена колонизацией менее вирулентными микроорганизмами. Например, при катетер-ассоциированных инфекциях, вызванных E. coli, у штаммов E. coli могут отсутствовать Р-фимбрии (32) (IIb).
Доказательства того, что наличие постоянного катетера является фактором риска выраженной заболеваемости или летальности, являются весьма неопределенными. Кажется несомненным тот факт, что частота летальных исходов после ТУРП и аналогичных операций примерно в 2 раза выше у катетеризированных пациентов. В то же время данные, полученные в Национальном исследовании по изучению выживаемости при инфекциях, и данные из других источников указывают на то, что катетер-ассоциированные инфекции сопровождаются низким риском летального исхода, даже у пожилых пациентов (33-36) (IIa, III).
Исследования по изучению нозокомиальной катетер-ассоциированной бактериемии, показывают, что атрибутивная летальность составляет от 9 до 13% (37, 38). Другие факторы риска включают в себя: тяжесть сопутствующего заболевания при адекватной антибактериальной терапии, наличие инфекции другой локализации и, возможно, наличие невыявленных урологических нарушений (39) (III).
Бактериурия, вызванная каким-либо одним штаммом, представляет собой универсальное явление, тогда как у большинства пациентов обнаруживаются 2 и более штаммов (40, 41) (IIb). Наиболее частым возбудителем является E. coli. Персистирование этого микроорганизма обусловлено наличием у него пилей 1-го типа, адгезина к уроэпителию и белка Тамма-Хорсфола. Другим возбудителем, редко обнаруживаемым при инфекциях другой локализации, кроме катетеризированных мочевыводящих путей, является Providencia stuartti (40, 42) (IIb, III). Для этого микроорганизма типично наличие адгезинов MR/K (38, 43) (IIb).
При катетер-ассоциированных ИМП также выделяются Pseudomonas, Proteus, Morganella и Acinetobacter spp. Приблизительно в 95% случаев бактериурия имеет полимикробный характер (7, 13, 14, 42) (IIb, III). В 1/4 случаев микроорганизмы, выделяемые из мочи, взятой из катетера, не обнаруживаются в моче, одновременно полученной путем надлобковой пункции мочевого пузыря. Это позволяет говорить о том, что некоторые микроорганизмы колонизируют только катетер (44) (IIb).
Очевидно, что длительная катетеризация может увеличивать длительность периода обструкции нижних отделов мочевыводящих путей вследствие закупорки катетера, образования мочевых камней, развития эпидидимита, простатита и абсцесса мошонки (7, 13, 14, 45-48) (IIa, III). Тем не менее, более чем у 30% умерших пациентов с длительно установленным катетером, у которых на момент смерти не было лихорадки, на вскрытии обнаруживались признаки острого пиелонефрита (49-51) (III).
Приблизительно у 50% пациентов с длительностью катетеризации >28 дней наблюдаются повторяющиеся эпизоды отложения солей и закупорки катетера (45-48) (IIa). Периодически возникающая задержка мочи может приводить к формированию ПМР и развитию осложненной восходящей инфекции. Возбудителем таких инфекций часто является P. mirabilis, благодаря его способности вырабатывать уреазу, которая ускоряет развитие струвитных камней (7, 13, 14, 45-48) (IIb, III).
Катетеризация мочевого пузыря продолжительностью >10 лет, например, у пациентов с поражением спинного мозга, повышает риск развития рака мочевого пузыря (52, 53) (IIa).
АЛЬТЕРНАТИВНЫЕ СПОСОБЫ ДРЕНИРОВАНИЯ МОЧЕВОГО ПУЗЫРЯ
Профилактика катетер-ассоциированных ИМП может осуществляться путем поиска альтернатив постоянной катетеризации и, возможно, путем лечения бактериурии.
Периодическая катетеризация является методом, широко используемым при нарушениях мочеиспускания, обусловленных широким спектром причин, включая нейрогенный мочевой пузырь. При данном способе катетеризации бактериурия развивается с частотой около 1-3% на 1 случай. Таким образом, к концу 3-й недели бактериурия наблюдается практически у всех пациентов (54-57) (III).
Теоретически можно предполагать, что при периодической катетеризации частота развития местной периуретральной инфекции, эпизодов лихорадки, образования мочевых камней и ухудшение функции почек будет намного ниже, чем у пациентов с постоянными катетерами, однако хорошо спланированных сравнительных исследований, посвященных этому вопросу, не проводилось.
К осложнениям периодической катетеризации относятся: кровотечение, воспалительные стриктуры уретры, ложный ход, эпидидимит, образование камней в мочевом пузыре и гидронефроз.
В одном рандомизированном исследовании не было выявлено различий в частоте развития клинически манифестных ИМП между «чистой» и «стерильной» периодической катетеризацией, хотя очевидно, что первый вариант характеризовался более низкими затратами (58) (Ib). Однако у пациентов без поражения спинного мозга, частота развития ИМП была ниже при «стерильной» периодической катетеризации, чем при «нестерильной» (59) (Ib). Европейская урологическая ассоциация (EAU) рекомендует периодическую катетеризацию в асептических условиях как метод выбора у пациентов с нейрогенной дисфункцией нижних отделов мочевыводящих путей. Преимущества профилактического назначения антибиотиков и соединений с антибактериальными свойствами, таких как метенамин, и инстилляции препаратов, содержащих повидон-йод и хлоргексидин, не доказаны.
Надлобковая катетеризация мочевого пузыря
Данный способ применяется в основном у пациентов, подвергающихся урологическим или гинекологическим процедурам. Надлобковая катетеризация имеет несколько преимуществ по сравнению с уретральными катетерами, особенно с точки зрения удобства для пациентов. Возможность пережатия надлобкового катетера облегчает проведение оценки мочеиспускания через уретру. Такой способ катетеризации сопровождается более низкой частотой бактериурии и, естественно, частотой образования стриктур уретры и болей в мочеиспускательном канале (60-64) (III). Однако рандомизированных исследований по изучению надлобковой катетеризации не проводилось.
Этот способ можно применять у мужчин без инфравезикальной обструкции. Тем не менее, кондомный мочеприемник может оказаться неудобным для смущающихся или неконтактных пациентов, а также у пациентов с ожирением и/или коротким половым членом. Также при таком способе отведения мочи может развиваться мацерация и язвы на коже полового члена. Существуют доказательства того, что кондомные мочеприемники сопровождаются значительно более низкой частотой развития бактериурии, по сравнению с длительной катетеризацией (65, 66) (III).
Имеется ряд данных, указывающих на значимое увеличение частоты развития бактериурии или клинически манифестных ИМП при использовании различных стентов, устанавливаемых эндоуретрально. Такие приспособления часто устанавливаются в простатический отдел уретры по целому ряду показаний, включая нейрогенный мочевой пузырь, профилактику стриктур и лечение задержки мочи.
Бактериурия, которая обычно протекает бессимптомно, развивается у 10-35% пациентов (67-74) (III). В уретру также устанавливают окклюзионные приспособления для лечения истинного стрессового недержания мочи. При этом удовлетворительный контроль мочеиспускания достигается примерно у 50% пациентов (67) (III).
Операции по отведению мочи
Иногда в качестве альтернативы постоянной катетеризации предлагают создавать удерживающий или неудерживающий резервуар мочи из сегментов толстой кишки. Частота развития бактериурии при этой процедуре варьирует, однако при некоторых вариантах реконструкции, особенно при отведении мочи через кондуит, бактериурия выявляется практически у всех пациентов (75, 76) (III).
ПРОФИЛАКТИКА КАТЕТЕР-АССОЦИИРОВАННОЙ БАКТЕРИУРИИ
Приведенные ниже рекомендации являются хорошо известными (7, 77, 78) (III). Установка постоянного катетера должна проводиться в асептических условиях. Для минимизации вероятности травмы уретры следует использовать достаточное количество смазки и катетер наименьшего подходящего размера. Данные с недостаточной степенью доказательности указывают на то, что «стерильный» или «чистый» способ катетеризации, а также использование антисептического геля не различаются между собой с точки зрения риска развития бактериурии (79, 80) (IIa). Обязательным является использование закрытой дренажной системы.
Однако снова наблюдается возросший интерес к использованию специального «невозвратного клапана» в качестве замены мочеприемника. Хотя формально применение этих клапанов не изучалось, предполагается, что риск колонизации микроорганизмами такого устройства будет значимым, хотя, возможно, он и уравновешивается удобством, связанным с возможностью периодического мочеиспускания. Очевидной является необходимость обеспечения адекватного потока мочи, поэтому рекомендуется употреблять внутрь достаточное количество жидкости, так чтобы поддерживать диурез на уровне >100 мл/ч. Бактериемию нельзя предотвратить местным применением антибиотиков или антисептиков (т.е. введением их в катетер, уретру или обработкой наружного отверстия уретры).
Не существует единого мнения по вопросу о том, с какой периодичностью следует менять установленный катетер. Частота смены катетера может определяться инструкциями производителя или гарантийными условиями. При неправильном функционировании или протекании катетера может потребоваться более частая замена. Смену катетеров всегда следует проводить на фоне парентерального введения высоких доз антибиотиков широкого спектра активности, которые также назначаются при наличии у пациента инфекции, сопровождающейся лихорадкой (7, 15, 25) (III). После удаления катетера необходимо провести контрольное культуральное исследование мочи.
Дополнительные меры профилактики
При производстве катетеров и стентов используется широкий спектр физических и химических материалов и покрытий. Очевидной целью разработки этих составов и покрытий является задержка развития бактериурии и предотвращение адгезии, роста и размножения бактерий.
Частота развития местной воспалительной реакции и некроза тканей при использовании катетеров является наибольшей для катетеров, изготовленных из натуральной резины, меньше – для катетеров из латекса, и минимальная – для силиконовых катетеров (81) (IIa). Катетеры из латекса наименее дорогие, однако при их использовании может возникать раздражение и аллергические реакции (46) (IIa). Силиконовые катетеры не имеют никаких преимуществ перед катетерами из латекса, однако они более удобны и поэтому наиболее предпочтительны для длительного использования. Силикон менее подвержен отложению на его поверхности солей, чем латекс. Тефлоновые или даже латексные катетеры с силиконовым покрытием в большей степени подвержены отложению солей на их поверхности (82-88) (IIa).
К другим стратегиям усовершенствования катетеров относятся включение в состав материала, из которого изготовлен катетер, биоцидов или антибиотиков, или разработка материалов с такими поверхностными свойствами, которые препятствуют адгезии бактериальных клеток. Тонкий слой полимерного матрикса на поверхности биоматериала обеспечивает дозированное высвобождение препаратов в мочу. К сожалению, какой бы ни был препарат, такие специальные катетеры не дают никаких преимуществ с точки зрения длительной профилактики бактериурии (84-88) (IIa), однако, могут успешно применяться для кратковременной катетеризации, особенно в отделениях интенсивной терапии (84-88) (IIa).
Покрытие из оксида серебра может при кратковременном использовании катетера задерживать развитие бактериурии, однако катетеры с покрытием из сплава серебра являются более эффективными благодаря преципитации мембранных белков бактерий, связанных с поверхностью, и подавлению колонизации микроорганизмов. Ионы серебра, связываясь с муреином, оказывают бактериостатическое действие, а в более высоких концентрациях ионы серебра обладают бактерицидным эффектом (89, 90) (IIb). Покрытия с фосфорилхолином и гепарином также могут препятствовать отложению солей и образованию биопленок (46, 91-94) (IIa).
И, наконец, имеется возможность применения постоянного электрического тока, который подводится к поверхности катетера (т.е. эффект электромеханической диссоциации), однако подобные устройства для клинического применения пока не разработаны.
Лечение бессимптомной бактериурии
В целом, бессимптомная бактериурия не требует лечения, поскольку это будет приводить к формированию резистентности у микроорганизмов.
В то же время имеются некоторые редкие исключения (7, 25, 95-97):
(a) лечение является частью плана по контролю нозокомиальных инфекций, вызванных особенно вирулентным микроорганизмом, распространенным в данном лечебном учреждении;
(b) пациенты с высоким риском развития серьезных осложнений (при нейтропении);
(c) пациенты, подвергающиеся урологическим операциям, или пациенты с имплантированными протезами;
(d) пациенты с рецидивирующей обструкцией катетера и персистирующей инфекцией, вызванной Proteus spp.;
(e) пациенты, инфицированные штаммами, часто вызывающими бактериемию, например Serratia marcescens.
Обычно после удаления катетера наблюдается спонтанная элиминация возбудителя из мочевыводящих путей (97, 98) (III). Однако у женщин пожилого возраста может потребоваться проведение лечения, поскольку бактериурия может не устраняться самостоятельно (99) (IIa).
Лечение клинически манифестной ИМП
Парентеральную антимикробную терапию следует проводить у катетеризированных пациентов при наличии у них лихорадки и ухудшении общего состояния, особенно при выделении возбудителя из крови, хотя результаты культурального исследования могут еще отсутствовать в то время, когда проводится выбор лечения. Несомненно, следует исключить другие причины лихорадки. Одним из компонентов лечения клинически манифестной катетер-ассоциированной бактериурии должно быть удаление катетера. Обоснованием этого является организация бактерий внутри биопленки, выстилающей наружную и внутреннюю поверхности катетера (99-102) (IIb, III).
После назначения стартовой эмпирической терапии выбор антибиотика следует корректировать на основании результатов культурального исследования мочи и самого катетера. Учитывая это, до начала антибактериальной терапии следует получить образец мочи для микробиологического исследования.
Обычно применяют антибиотики широкого спектра действия. При отсутствии в моче грамположительных кокков, можно проводить монотерапию аминогликозидами. Стартовая эмпирическая терапия может быть изменена после получения результатов определения чувствительности выделенного возбудителя к антибиотикам. Длительность лечения обычно составляет 10-14 дней (99) (Ib).
При отрицательных результатах культурального исследования крови и/или небольшой выраженности симптомов пациентам можно назначить короткий курс терапии пероральными антибиотиками (3-5 дней). Обычно это позволяет добиться стерилизации мочи без формирования резистентных штаммов бактерий (7, 99) (IIa, III). В редких случаях у таких пациентов при культуральном исследовании может обнаруживаться инфекция, вызванная кандидами. Эта инфекция, как правило, протекает бессимптомно и проходит самостоятельно без лечения. При наличии осложненной грибковой инфекции может быть показана системная терапия амфотерицином В или флуконазолом (103, 104) (IIa).
Длительная терапия антибиотиками не эффективна, поскольку катетер сам по себе является инородным телом, поэтому моча не может постоянно оставаться стерильной (7, 99-102) (IIa, III).
ПРОФИЛАКТИКА ПЕРЕКРЕСТНОГО ИНФИЦИРОВАНИЯ
Микрофлора периуретральной слизистой муфты, поверхности катетера и дренажной системы, резервуар с контаминированной мочой и кожа пациента – все это является источником инфекции, которая легко может передаваться контактным путем через руки медицинского персонала (9597, 106) (IIb, III).
Риск инфицирования может быть снижен, если осуществлять уход за катетеризированными мочевыводящими путями как за открытой раной, т.е. пользоваться одноразовыми перчатками после обработки рук антисептиками (100, 105, 106) (IIa, III).
Возможно, следует пересмотреть вопрос о добавлении антимикробных препаратов в мочеприемники или применении внутрь метенамина, который, теоретически, приводит к выделению в мочу формальдегида (7) (IV).
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Лечение повышенного белка в моче зависит от причины, которая помешала почкам полностью вернуть в кровь белок, поступивший в ее канальцы, и он оказался там, где ему быть не положено — в моче.
Присутствие белка в моче – в соответствии с физиологическими нормами – практически нулевое (менее 0,03 г в литре урины за сутки). Если этот показатель выше, то это уже можно считать протеинурией. Именно так в клинической медицине называется повышенный белок в моче. Данная патология подразделяется на протеинурию преренальную (при усиленном распаде белка в тканях), ренальную (при почечных патологиях), постренальную (при заболеваниях мочевыводящей системы) и инфраренальную (секреторную). В свою очередь — по характеру ключевого патофизиологического механизма — каждый из этих видов имеет массу подвидов.
Следует отметить, что повышенный белок в моче не всегда является признаком какой-либо болезни. Так называемая физиологическая протеинурия проявляется при избытке в рационе белковой пищи, при длительном мышечном напряжении, пребывании на холоде или на солнце, при стрессах. Как только исчезает негативный фактор, все приходит в норму. И в подобных случаях лечение повышенного белка в моче не требуется.
А вот постоянно или длительно повышенный белок в моче является свидетельством весьма серьезных проблем со здоровьем. Чем выше содержание белка в моче (более 0,5 г/л в день), тем реальнее развитие почечной недостаточности.
В первую очередь, лечение повышенного белка в моче требуется при гломерулярных болезнях – остром и хроническом гломерулонефрите (нефрите) и нефротическом синдроме. Повышение содержания протеинов в моче также числится в списках симптомов таких заболеваний, как пиелонефрит, цистит, уретрит, туберкулез почек, киста почки, простатит, амилоидоз, сахарный диабет, ревматоидный артрит, системная склеродермия, подагра, артериальная гипертензия, сердечная недостаточность, малярия, лейкемия, гемолитическая анемия.
Кроме того, повышенный белок в моче отмечается при негативном воздействии некоторых лекарственных препаратов, отравлениях токсическими веществами и тяжелыми металлами, при хроническом дефиците калия в организме. А когда белок в моче выявлен у беременной женщины в последнем триместре гестации, то налицо явный симптом нефропатии — дисфункции плаценты, которая чревата преждевременными родами.
Совершенно очевидно, что лечение повышенного белка в моче может быть либо этиологическим — направленным на устранение причины основной болезни, либо патогенетическим, когда целью терапии является механизм развития заболевания.

За концентрацию белков в моче отвечает почечная базальная мембрана – гломерулярный барьер, который фильтрует протеины плазмы крови и не допускает их выхода в мочу. Когда нарушается проницаемость этого барьера, уровень белка в моче возрастает.
При остром гломерулонефрите это происходит вследствие стрептококковой, стафилококковой или пневмококковой инфекции (фарингита, ангины, синусита, пневмонии и др.), токсины которой повреждают почечную мембрану и проводят к образованию антител к М-протеину стрептококка и иммунному воспалению клубочков почки.
Нефротический синдром считается аутоиммунным заболеванием, которое может развиваться при красной волчанке или системном нарушении белкового обмена (амилоидозе), а также при сахарном диабете (диабетическая нефропатия) и злокачественных новообразованиях. Обострения и рецидивы нефротического синдрома могут провоцироваться инфекциями. У пациентов с такими диагнозами отмечаются отеки, повышенное артериальное давление, повышенный белок в моче (3-3,5 г/л в сутки), а также наличие крови в моче (макрогематурия) и сокращение суточного диуреза (выделения мочи).
При данных заболеваниях — после уточнения диагноза и антибактериальной терапии имеющихся инфекций — урологи назначают следующие основные препараты для лечения повышенного белка в моче: кортикостероиды (преднизолон или метилпреднизолон); цитостатики (циклофосфамид); антиагреганты (дипиридамол).
Метилпреднизолон является аналогом преднизолона (синтетического гормона надпочечника кортизона), но у него меньше побочных действий и лучшая переносимость больными как при внутримышечном введении (суспензия для инъекций метилпреднизолона натрия сукцинат), так и при пероральном применении (в таблетках по 0,004 г). Дозировку лекарственного средства определяет врач в зависимости от степени тяжести заболевания: средняя суточная доза составляет 0,004-0,048 г (в форме таблеток); внутримышечно — 4-60 мг в сутки. Курс лечения – от одной недели до месяца.
Побочные действия данного препарата: задержка натрия и воды в тканях, потеря калия, повышение АД, мышечная слабость, ломкость костей (остеопороз), повреждение слизистой желудка, снижение функции надпочечников. Применение метилпреднизолона в период беременности (как и всех кортикостероидов, поскольку они проникают через плаценту) возможно, если ожидаемый эффект лечения для женщины превышает потенциальный риск для плода.

Лекарственное средство циклофосфамид (синонимы – цитофорсфан, цитоксан, эндоксан, геноксол, митоксан, процитоке, сендоксан, клафен) препятствует делению клеток на уровне ДНК и обладает противоопухолевым действием. Циклофосфан используется в качестве иммунодепрессивного средства, так как подавляет деление В-лимфоцитов, участвующих в иммунном ответе. Именно это действие используется в лечении повышенного белка в моче при гломерулонефритах и нефротическом синдроме.
Препарат (в ампулах по 0,1 и 0,2 г) вводят внутривенно и внутримышечно — согласно назначенной врачом схеме лечения из расчета 1,0-1,5 мг на килограмм массы тела (50-100 мг в сутки). Внутрь принимают таблетки по 0,05 г, дозировка: по 0,05-0,1 г дважды в день.
В числе противопоказаний данного лекарственного средства: повышенная чувствительность, тяжелые нарушения функции почек, гипоплазия костного мозга, лейкопения, анемия, онкологические заболевания, беременность и лактация, наличие активных воспалительных процессов. Возможные побочные эффекты циклофосфамида: тошнота, рвота, боли в области живота, нарушение менструального цикла, алопеция (выпадение волос), потеря аппетита, снижение уровня лейкоцитов крови, изменение цвета ногтевых пластин.

Для терапии данной патологии врачи используют дипиридамол (синонимы — курантил, персантин, пенселин, ангинал, кардиофлукс, корозан, диринол, тромбонин и др.). Этот препарат тормозит склеивание (агрегацию) тромбоцитов и препятствует образованию тромбов в кровеносных сосудах, поэтому его применяют в целях предупреждения образования тромбов после операций, при инфаркте миокарда и проблемах с мозговым кровообращением. При хронических заболеваниях почек, связанных с нарушением функций гломерулярного барьера, данное лекарственное средство способствует улучшению фильтрации крови.
Таблетки-драже по 0,025 г рекомендуется принимать по 1 шт. три раза в день. В отдельных случаях дипиридамол может иметь побочные эффекты в виде кратковременной гиперемии лица, учащения пульса и кожных высыпаний. Противопоказание к применению данного лекарства — распространенный склерозирующий атеросклероз коронарных артерий.
Для симптоматического лечения повышенного белка в моче применяются гипотензивные, мочегонные и спазмолитические средства.
Например, среди диуретиков рекомендуется мочегонный препарат растительного происхождения канефрон, в составе которого содержатся золототысячник, кожура шиповника, любисток и розмарин. Он уменьшает проницаемость капилляров почек и способствует нормализации их функций. Кроме того, канефрон работает как уросептик и спазмолитик.
Канефрон выпускается в форме каплей и драже. Дозировка для взрослых — по 2 драже или по 50 капель трижды вдень; детям в возрасте 1-5 лет — по 15 капель 3 раза в сутки, старше 5 лет — по 25 капель или по одному драже трижды в течение суток.

Применение антибактериальных препаратов в комплексном лечении повышенного содержания белка в моче направлено на ликвидацию очага инфекции в начальной стадии заболевания и подавления инфекции в дальнейшем течении болезни.
Из антибиотиков пенициллинового ряда во многих случаях — при воспалении легких (в том числе с абсцессами), ангинах, холецистите, инфекциях желче- и мочевыводящих путей и кишечника — назначается ампициллин.
Таблетки и капсулы по 0,25 г назначают принимать внутрь: взрослым – по 0,5 г 4-5 раз в день, независимо от приема пиши; детям доза рассчитывается в зависимости от веса — 100 мг/кг. Длительность курса терапии составляет минимум 5 дней.
Применение ампициллина может вызывать нежелательные побочные реакции в виде кожной сыпи, крапивницы, отека Квинке; при продолжительном лечении возможно развитие суперинфекции. Во избежание этого необходимо одновременно принимать витамины С и группы В. К противопоказаниям данного антибиотика относятся повышенная чувствительность к пенициллину и склонность к аллергии.
Лечение повышенного белка в моче антибиотиками не обходится без олеандомицин (аналог — олететрин) — антибиотик группы макролидов — активен в отношении многих грамположительных, грамотрицательных и анаэробных бактерий, устойчивых к пенициллину. Его прописывают (таблетки по 125 тыс. ЕД и по 250 тыс. ЕД) при ангине, отите, синусите, ларингите, пневмонии, скарлатине, дифтерии, коклюше, гнойном холецистите, флегмонах, а также при сепсисе стафилококкового, стрептококкового и пневмококкового происхождения.
Доза для взрослых — по 250-500 мг (в 4-6 приемов, суточная доза не более 2 г); для детей до 3 лет — 20 мг на килограмм массы, 3-6 лет — 250-500 мг в сутки, 6-14 лет — 500 мг-1 г, после 14 лет — 1-1,5 г в сутки. Курс лечения длится от 5 до 7 дней.
Возможные побочные эффекты: кожный зуд, крапивница, нарушения функции печени (редко). В период беременности и лактации олеандомицин применяют с большой осторожностью и только по строгим показаниям лечащего врача.
О том, что белок в моче значительно повышен, говорят такие признаки, как быстрая утомляемость и головокружение, головная боль и боль в области поясницы, отеки, снижение аппетита, озноб, рвота или тошнота, повышение артериального давления, одышка и учащенное сердцебиение. Самолечение в данном случае недопустимо и невозможно!
Адекватное и эффективное лечение повышенного белка в моче может назначить только врач – уролог или нефролог – после лабораторного исследования мочи, обследования пациента и всестороннего анализа клинической картины заболевания.
источник
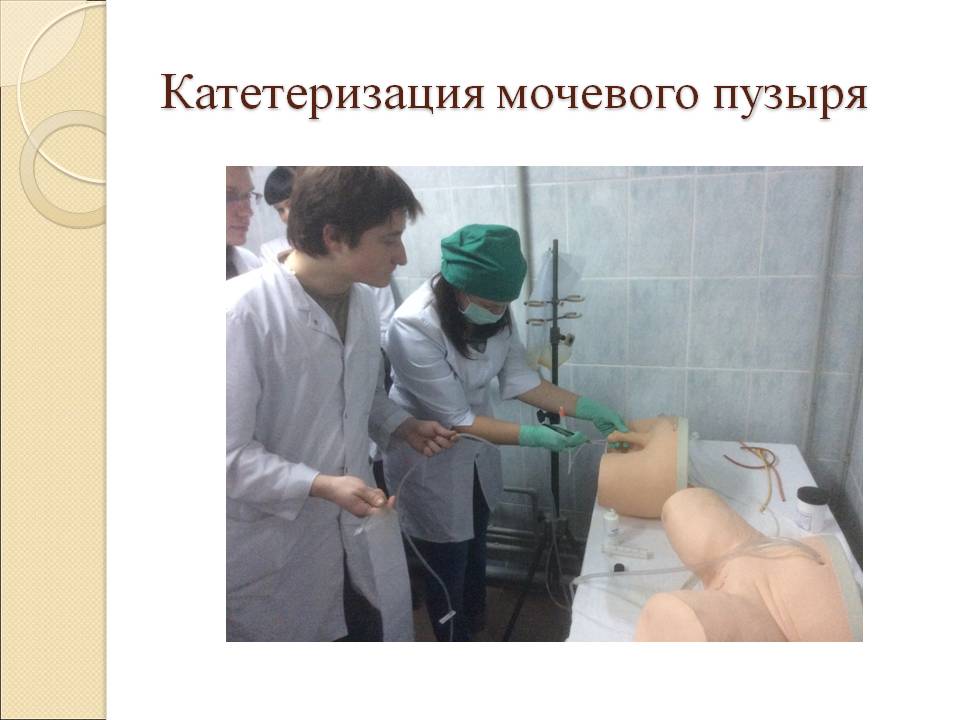
Катетеризация мочевого пузыря относится к инвазивным манипуляциям. Во время постановки мочевого катетера существует риск осложнений, среди которых выделяют травматизацию слизистой оболочки и занесение инфекции.
Постановка мочевого катетера — распространенная медицинская манипуляция, которая проводится для нормализации оттока мочи при различных состояниях.
Катетеризация мочевого пузыря показана пациентам, которым проводятся операции на брюшной полости.
- Нарушение проходимости мочевыводящих путей. Такой процесс связан с патологиями: аденома простаты, опухоль нижнего отдела мочевого пузыря, анафилактический шок, травмы. У женщины нарушения проходимости уретры встречаются намного реже.
- Оперативные вмешательства на брюшной полости. Показаниями для катетеризации считаются те операции, которые проводятся в малом тазу у женщин. Это осуществляется для того, чтобы обеспечить врачу доступ к матке и придаткам. Мужчинам эта манипуляция необходима при оперативном лечении прямой и сигмовидной кишки через абдоминальный доступ.
- Малые гинекологические операции. Манипуляции осуществляемые гинекологом, которые требуют введения инструментария в полость матки, проводятся исключительно при пустом мочевом пузыре. Одной из таких операций является лечение маточного кровотечения путем выскабливания. Перед процедурой ставится катетер, чтобы при проведении вмешательства, моча не накапливалась в мочевом пузыре у женщин.
- Госпитализация в реанимационное отделение. Пациенты которые проходят лечение в реанимации, подлежат катетеризации. Это для того, чтобы медицинский персонал следил за количеством выделяемой мочи. При тяжелых болезнях часто нарушается выработка мочи, что становится причиной осложнений. Большое значение имеет для тех пациентов, которым проводится форсированный диурез.

Процедура проводится быстро, а при достаточной квалификации медицинского персонала проблем не возникает.
Сегодня существует два вида катетера: гибкие и металлические. Гибкие изготовлены из поливинилхлорида — гипоаллергенного полимера. Используют для катетеризации мочевого пузыря у мужчин, без болезней простаты.
Если у мужчины простатит или аденома простаты, то для прохождения участка уретры, возле которого располагается железа, используют металлический.
Использование гибкого изделия допускается среднему медицинскому персоналу, а вот постановка металлического — врачебная манипуляция.
Цистит после катетеризации вызван такими причинами: занесение инфекции и травмирование мочевыводящих путей.
Воспаление мочевого пузыря при правильной постановке встречается крайне редко. Обусловлено индивидуальными особенностями организма. Развитие цистита свидетельствует чаще о нарушении методики катетеризации.
Травматический цистит встречается чаще у мужчин. Это связано с тем, что уретра мужчины имеет два анатомических изгиба.
Прохождение катетера через эти изгибы приводит к нарушению целостности слизистой оболочки.
Как правило, патологический процесс имеет тенденцию к распространению. Воспаление переходит из уретры в мочевой пузырь.
Травматический цистит в послеоперационном периоде считается стерильным, так как не сопровождается инфекционным поражением.
В течение послеоперационного периода пациентам вводят антибиотики, которые подавляют активность микроорганизмов.
Если же причина развития болезни связана с нарушением правил асептики и антисептики при манипуляции, то развивается классический бактериальный цистит.
Бактериальная природа после операций встречается крайне редко, так как идет антибиотикотерапия, и бактерии не успевают вызвать воспаление.
Симптомы болезни проявляются спустя несколько часов после постановки катетера. Пациенты выражают жалобы на жжение в области мочевого пузыря и уретры.
При травматическом цистите в моче появляются примеси крови. Выраженность гематурии напрямую зависит от площади раневой поверхности, от того насколько сосуды повреждены.
При воспалительном процессе катетер удаляют. Повторное введение после цистита допускается только после выздоровления.
Лечение травматического цистита требуется в тех случаях, когда повреждение слизистой оболочки существенное.
Для улучшения состояния пациентам назначают противовоспалительные средства. Часто используют «Ибупрофен», так как этот препарат с жаропонижающим эффектом.
Лечение противовоспалительными средствами помогает устранить неприятные симптомы болезни, в том числе и отечность слизистой, что нормализует выведение мочи.
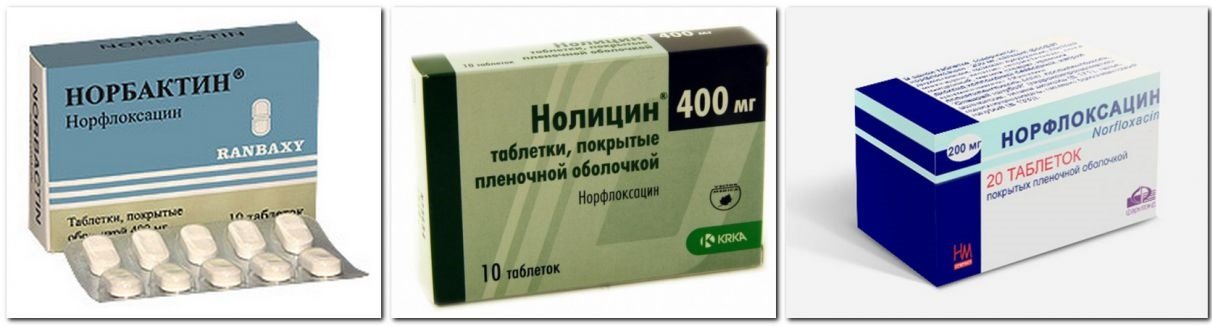
Если катетеризация проводилась для облегчения оттока мочи, а не для проведения операции или другого вмешательства, то с профилактической целью назначают антибиотики.
Это для того, чтобы исключить риск присоединения инфекции к стерильному воспалению. С этой целью используют антибиотики широкого спектра, которые уничтожают большое количество видов патогенных микроорганизмов.
Для уменьшения неприятных симптомов, пациентам рекомендуется соблюдать постельный режим.
В горизонтальном положении болевые ощущения уменьшаются, так как моча скапливается не возле травмированной уретры, а около задней стенки мочевого пузыря.
Смеха лечения для пациентов с циститом подбирается индивидуально для каждого пациента, с учетом сопутствующей патологии, проводимого лечения, а также тяжести травматизации.
Травматический цистит после катетеризации мочевого пузыря является погрешностью медицинского персонала и чаще наблюдается в послеоперационный период. При квалификации работников сферы здравоохранения, этого осложнения избегают.
источник