Иммунофиксация — это ключевой тест для подтверждения и типирования М-компонента с целью диагностики гаммапатий (миелома, болезнь Вальденстрема, лимфома, амилоидозы и пр.) при помощи антисывороток к тяжелым (G, A, M, D, E) и легким (каппа, лямбда) цепям иммуноглобулинов.
При выявлении аномальных полос на электрофореграмме сывороточных белков, в первую очередь в зонах гамма-глобулинов, а также в зонах альфа- и бета-глобулинов (эти полосы могут быть скрыты за обычными белками соответствующих зон), всегда следует заподозрить наличие моноклональных белков, т.е. гаммапатию. Для идентификации этих аномальных полос применяется методика иммунофиксации. Кроме того, иммунофиксация позволяет выявить моноклональные белки небольшой концентрации и/или скрытые другими обычными белками электрофоретического профиля.
Электрофорез с иммунофиксацией – это простая методика, которая позволяет фиксировать белок in situ после электрофореза путем образования нерастворимого комплекса с антителом к нему.
Результаты. Результат иммунофиксации сыворотки каждого пациента представлен в виде шести дорожек — одна референсная дорожка (ELP) на которой зафиксированы все белки и пяти дорожек обработанных индивидуальными антисыворотками против цепей Ig (G, А, М, каппа, лямбда или другими выбранными антисыворотками). — В первую очередь проводится оценка референсной дорожки на наличие качественных аномалий. Затем анализируются дорожки, обработанные антисыворотками. В случае присутствия в образце моноклональных Ig, выявленные на дорожках с антисыворотками полосы (одна полоса на любой из дорожек тяжелых цепей и одна на дорожка легких цепей) сравниваются с аномальными полосами на референсной дорожке – они должны иметь одинаковую скорость.
Материал для исследования: сыворотка крови или моча
Пробоподготовка: не требуется.
Совместимость с прибором
№ по каталогу
Наименование набора
Кол-во тестов на набор
Белковые фракции с иммунофиксацией ГИДРАГЕЛЬ (HYDRAGEL 1 IF (SM))
Белковые фракции с иммунофиксацией ГИДРАГЕЛЬ (HYDRAGEL 2 IF (SM))
Белковые фракции с иммунофиксацией ГИДРАГЕЛЬ (HYDRAGEL 4 IF (SM) — ACID VIOLET))
Белковые фракции с иммунофиксацией ГИДРАГЕЛЬ (HYDRAGEL 4 IF (SM) – AMIDOBLACK)
Белковые фракции с иммунофиксацией ГИДРАГЕЛЬ (HYDRAGEL 9 IF (SM))
Антисыворотки (обязательны для анализа, различные фасовки и комбинации)
Антисыворотки для иммунофиксации (IF ANTISERA AND FIXATIVE SOLUTION (SM))
Антисыворотки для иммунофиксации ANTI-Ig A (ANTI-Ig A 1 ml (SM))
Антисыворотки для иммунофиксации ANTI-Ig G (ANTI-Ig G 1 ml (SM))
Антисыворотки для иммунофиксации ANTI-Ig M (ANTI-Ig M 1 ml (SM))
Антисыворотки для иммунофиксации ANTI-KAPPA (ANTI-KAPPA 1 ml (SM))
Антисыворотки для иммунофиксации ANTI-LAMBDA (ANTI-LAMBDA 1 ml (SM))
Антисыворотки для иммунофиксации ANTI-Ig DE (ANTI-Ig DE 0,5 mL (SM))
Антисыворотки для иммунофиксации ANTI-Ig D (ANTI-Ig D 1 ml (SM))
Антисыворотки для иммунофиксации ANTI-Ig E (ANTI-Ig E 1 ml (SM))
Антисыворотки для иммунофиксации ПОЛИВАЛЕНТ (POLYVALENT 8 ml)
Антисыворотки для иммунофиксации ANTI-Ig A (ANTI-Ig A 8 ml (SM))
Антисыворотки для иммунофиксации ANTI-Ig G (ANTI-Ig G 8 ml (SM))
Антисыворотки для иммунофиксации ANTI-Ig M (ANTI-Ig M 8 ml (SM))
Антисыворотки для иммунофиксации ANTI-KAPPA (ANTI-KAPPA 8 ml (SM))
Антисыворотки для иммунофиксации ANTI-LAMBDA (ANTI-LAMBDA 8 ml (SM))
Контрольные материалы
Контрольная сыворотка для электрофореза ИФ (IF CONTROL)
Дополнительные реагенты и расходные материалы (по потребности)
Промывающий раствор для электрофореза ГИДРАЗИС (HYDRASYS WASH SOLUTION)
Обесцвечивающий раствор для электрофореза (DESTAINING SOLUTION)
Аксессуары для иммунофиксации и исследования белка Бен Джонса (для гелей форматом 1 образец на гель)
Аксессуары для иммунофиксации (для гелей форматом 2 или 4 образца на гель)
Аксессуары для иммунофиксации (для гелей форматом 9 образцов на гель)
источник
Иммунохимически идентифицировать белки на электрофореграмме без потери наглядности и четкости классической электрофоретической картины позволяет метод иммунофиксации (ИФ).
При выполнении иммунофиксации на одной и той же пластине с агарозным гелем проводят несколько электрофоретических разделений исследуемого образца, после чего один из треков окрашивают сразу после окончания фореза (он служит контролем), а на поверхность остальных наносят антисыворотки определенной специфичности.
В месте расположения белка, прореагировавшего с родственной ему антисывороткой, через некоторое время (обычно в пределах часа) образуется преципитат, который полностью сохраняет форму и положение изучаемой фракции. Предварительно отмыв несвязавшиеся белки солевым раствором, пластины окрашивают. Зону миграции белка уточняют, соотнося положение преципитата, образованного этим белком, с контрольной фореграммой.
Иммунофиксацию широко используют в диагностике моноклональной секреции. К наиболее типичным ситуациям относятся:
1) иммунохимическая идентификация небольших М-градиентов, особенно при нормальном содержании поликлональных иммуноглобулинов;
2) выявление и идентификация скрытых М-градиентов, когда моноклональный белок мигрирует в зоне а- или b-глобулинов и маскируется нормальными белками этих фракций, особенно при низком уровне продукции.
В ряде случаев иммунофиксация позволяет распознать так называемые ложные М-градиенты — электрофоретически гомогенные полосы, напоминающие М-градиент, но не относящиеся к иммуноглобулинам. Отсутствие специфического преципитата в зоне такой полосы при реакции с антисыворотками к Н- и L-цепям иммуноглобулинов позволяет отвергнуть предположение о наличии парапротеина в исследуемом образце.
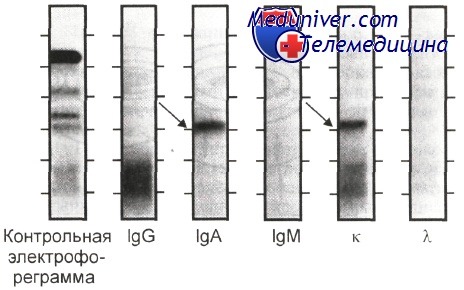
При проявлении электрофореграмм антисыворотками к а- и к-цепям иммуноглобулинов в b2-зоне выявлен М-градиент, образованный парапротеином Ак (указан стрелкой).
Иммунофиксация является методом выбора при анализе множественной секреции, если в образце присутствуют два и более М-градиентов.
Помимо высокой специфичности и разрешающей способности, достоинством метода является также его высокая чувствительность. Это объясняется двумя факторами: накоплением белка (антител) в зоне градиента при образовании специфического преципитата и минимальной диффузией антигена при реакции с антисывороткой. При иммунофиксации можно выявить следовые М-градиенты, которые не видны на окрашенной электрофореграмме.
Основная методическая трудность — подбор адекватного разведения образца для получения плотного, хорошо видимого преципитата. Если образец разведен недостаточно, то преципитат может раствориться в избытке антигена (исследуемый белок). При слишком большом разведении образца образовавшийся преципитат можно не увидеть. В обоих случаях имеет место ложноотрицательный результат.
В последние годы благодаря исключительно высокой информативности метода и появлению коммерческих диагностических наборов, укомплектованных высокоаффинными антисыворотками (что приводит к получению стабильных результатов), иммунофиксация в большинстве диагностических ситуаций оттеснила на второй план традиционный иммуноэлектрофорез (ИЭФ).
Чувствительность иммунофиксации можно значительно повысить, если использовать для разделения белков противоточный изотахофорез (ИТФ) на ацетат-целлюлозной мембране, предложенной Г. И. Абелевым и соавт.. Это метод электрофореза в неоднородной системе буферов, имеющих общий катион, но разные анионы.
При изотахофорезе (ИТФ) ионы разделяемого образца располагаются в порядке уменьшающейся электрофоретической подвижности между двумя видами анионов буфера: «ведущим» (с более высокой подвижностью) и «замыкающим» (с меньшей подвижностью). Изотахофорез (ИТФ) позволяет одновременно с разделением концентрировать в 10—100 раз белки, находящиеся в высокоразбавленных растворах.
В связи с этим метод хорошо подходит для выявления и индентификации белка Бенс-Джонса в моче, а также для исследования малобелковых биологических жидкостей, доступных в небольшом объеме, ограничивающем предварительное концентрирование (церебральная и слезная жидкости, слюна и т. д.).
источник
Код исследования: В69
Определение свободных легких цепей иммуноглобулинов (капа и лямбда) в сыворотке крови и в суточной моче (выявление белка Бенс-Джонса) – показатель в диагностике множественной миеломы (болезнь Рустицкого-Калера, миеломная болезнь). Основные показания к применению (c учетом клинической картины заболевания): боли в костях, патологические переломы, анемия, полинейропатия, неясные лихорадки, гиперкальциемия, протеинурия, изменения картины электрофореза белков.
Множественная миелома – это злокачественное заболевание плазматических клеток в результате их злокачественной пролиферации, происходящей главным образом в костном мозге, но иногда и в экстрамедуллярных очагах. Относится к гематоонкологическим заболеваниям. Поражаемые клетки – это плазматические клетки, являющиеся разновидностью лейкоцитов, которые вырабатывают в нашем организме иммуноглобулины (антитела). Плазматические клетки — разновидность клеток соединительной и кроветворной тканей; образуются у позвоночных животных и человека из стволовых кроветворных клеток костного мозга, являются конечным этапом развития B-лимфоцита. Основная функция – выработка антител. Каждый плазмоцит секретирует иммуноглобулины только одного класса.
Термин «миелома» впервые был предложен в 1873 году Рустицким для обозначения опухоли, развивающейся множественно в костном мозге. В 1900 г. Райт обратил внимание на связь этой болезни с поражением плазматических клеток.
Миелому обычно называют «множественной миеломой», поскольку в костях обнаруживают сразу несколько очагов или участков образования опухолей. Единичная опухоль из миеломных клеток называется изолированной плазмацитомой.
Опухолевая ткань разрастается преимущественно в плоских костях — череп, рёбра, таз и в позвоночнике, приводя к остеолизису и остеопорозу. Множественная миелома может проявляться патологическими переломами, болями в костях, анемией, снижением гемоглобина, тромбозами, кровотечениями. При разрушении костей в крови увеличивается содержания кальция , который в виде конкрементов откладывается в почках, лёгких. Миеломная нефропатия в основном обусловлена поступлением через почечный фильтр парапротеинов. Характерным для миеломной болезни является частота бактериальных инфекций вследствие уменьшения количества нормальных иммуноглобулинов и нарушения образования антител.
Иммуноглобулины разных классов (G, A, M, D, E) характеризуются общим строением. Легкие L-цепи одинаковы у всех иммуноглобулинов, тогда как тяжелые Н-цепи гетерогенны. Молекула иммуноглобулина содержит две легкие и две тяжелые цепи. Легкие цепи существуют в двух формах: каппа-цепи и лямбда-цепи.
От типа тяжелых цепей зависит принадлежность молекулы иммуноглобулина к тому или иному классу иммуноглобулинов.
Вырабатываемые пораженными клетками антитела различных видов в избыточных количествах, легкие и тяжелые цепи иммуноглобулинов принято называть парапротеинами. Их можно обнаружить в крови или в моче методом электроиммунофореза. Легкие цепи способны проходить через почечный фильтр и поэтому их находят в моче. Лёгкие цепи иммуноглобулинов, обнаруживаемые в моче или в крови называются — белок Бенс-Джонса. Белок Бенс-Джонса, примерно в 60% случаев, выявляют чаще в моче больных множественной миеломой. Чаще легкие цепи обнаруживаются в моче за счет концентрирующего эффекта и реже, в крови. Считается, что при доброкачественных парапротеинемиях белок Бенс-Джонса не выявляется, поэтому его определение используют как скрининговое исследование при подозрении на миелому.
Следует учитывать, термин — «белок Бенс-Джонса» не всегда можно отнести к наличию легких цепей. Поскольку, даже при наличии в моче легких цепей только в 10% случаев их поведение соответствует тому эффекту, который показал автор (преципитация и растворение при нагревании и охлаждении мочи). Для определения белка Бенс-Джонса применяют нагревание мочи. При 56° С белки преципитируют, а при точке близкой к кипению вновь растворяются.
По иммунохимической классификации выделяют 5 основных типов миеломы: G, A, D, Е и Бенс-Джонса (обнаруживаются только легкие цепи – «болезнь легких цепей»). К редким формам относятся несекретирующая миелома (1-3%), М-миелома, биклональная миелома (2-4%). Частота встречаемости типов миеломы примерно соответствует концентрации различных классов иммуноглобулинов в сыворотке крови: G-миелома обнаруживается в среднем в 60% случаев, А-миелома — в 25%, D-миелома — в 1%, Е- миелома 1%. М-миелома и несекретирующая форма встречаются очень редко. Чаще встречаются G- и A-миелома, миелома Бенс-Джонса (15-20%). При несекретирующей миеломе для диагностики используют определение бета-2-микроглобулина.
Легкие цепи каппа и лямбда в молекуле парапротеинов распределяются приблизительно равномерно, как и при парапротеинемии Бенс-Джонса, при D-миеломе обычно обнаруживают лямбда-цепи.
У части пациентов миеломные клетки продуцируют только легкие цепи и не продуцируют тяжелых цепей. В этом случае говорят о болезни легких цепей или миеломе Бенс-Джонса. Эти цепи обнаруживаются в моче при отсутствии патологических иммуноглобулинов в сыворотке крови. Примерно у 30% больных обнаруживаются легкие цепи в моче — легкие цепи каппа. Обнаружение белка Бенс-Джонса, типа лямбда является худшим прогностическим признаком, поскольку этот белок более нефротоксичен (приводит к развитию почечной недостаточности) чем белок каппа.
Следует учитывать, что обнаружение парапротеинов увеличивается после 50 лет и достигает 4-7 % у лиц старше 65 лет (моноклональная гаммапатия невыясненного значения). Этот термин указывает на случаи парапротеинемии без других признаков плазмаклеточного или онкогематологического заболевания.
Таким образом, при ряде заболеваний в сыворотке крови появляется большее количество какого либо из класса иммуноглобулинов (их еще называют парапротеины) на фоне присутствия и других видов иммуноглобулинов. При электрофорезе сыворотки,которая содержит нормальные иммуноглобулины, их миграция идет в виде широкой, размытой полосы, а моноклональные (парапротеины) — проявляются в виде более узкой и четко очерченной. Моноклональные иммуноглобулины в силу своей однородности мигрируют при электрофорезе с образованием четко сформированной полосы, которую называют М-градиент.
Материал: Cыворотка крови, суточная моча.
Метод: Иммунофиксации в агарозном геле.
Тест – система: HELLABIO.
Референсные значения (норма): Не обнаружено.
Основные показания к назначению анализа:
1. Диагностика миеломной болезни;
2. Макроглобулинемия Вандельстрема;
3. Амилаидоз;
4. Болезнь тяжелых цепей.
Понижение значения:
1. Свидетельствует об эффективности терапии.
источник
зарегистрируйте свою электронную почту на сайте и получайте дополнительные информационные материалы по аутоиммунной диагностике
где сдать анализ крови на тест анализы спб СПб инвитро Петербург Питер на целиакию аутоиммунные заболевания аутоантитела аутоиммунная диагностика Лапин autoimmun антиядерные лабораторная антинуклеарный фактор антинуклеарные антитела HEp-2 тип волчанка свечения амилоидоз склеродермия иммуноблот ревматоидный цитруллиновый расшифровка экстрагируемые скрининг заболевания смешанное системная СКВ артрит дсДНК CCP ССР АЦЦП саркоидоз антинейтрофильные криоглобулины гранулематозные АНФ АНЦА ANCA ENA иммунофиксация васкулиты Крона целиакия аутоиммунный печени язвенный колит глиадину трансглутаминазе стероидпродуцируюшим Вегенера яичника эндокринопатии пузырные пузырчатка пемфигоид рассеянный склероз миастения миелина белок олигоклональный изоэлектрофокусирования IgG IgA IgM легкие цепи полиневрит ганглиозидам полимиозит парапротеин миелома неоптерин островковые GAD антимитохондриальные гладкие скелетные мышцы ASCA колит антигену фосфолипидный синдром кардиолипину фосфолипидам гликопротеину нуклеосомам SSA SSB RNP Sm CENT Scl Jo-1 АМА антикератиновые антиперинуклеарный MCV LKM-1 рецептору иммунофлюоресценция ИФА иммунологическая лаборатория университет санкт-петербург павлова Чардж-Стросса полиангиит микрокристаллические первичный билиарный цирроз трансглутаминаза трансглютаминаза критерии ревматоидного артрита 2010 года СПб Питер Петербург нейрогенетика
01 02 15 020, Копрограмма, содержание кальция в крови, VES, 01 02 15 240, kak opredelit efffektivnost lekarstv po acr20 50 70, анца, основной белок миелина, антинуклеарный фактор и антитела к, ЦИК, Аутоантитела IgG к антигену ANA Ro 52, Теликобактер, антипротромбиновые, в чем измеряется титр антител, антимиелины, Пагет, Комплемент и его фракции в крови, сколько стоит анализ кала на кальп, НАО, КОД 01 02 15 145, иммунология.
Парапротеинемии и иммунофиксация
Диагностика парапротеинемий множественная миелома, болезнь легких цепей, амилоидоз, болезнь Вальденстрема, моноклональная гаммапатия неясного значения (MGUS)
Парапротеины являются первыми описанными опухолевыми маркерами, т.е. отражают объем опухоли. Как и другие онкомаркеры парапротеины встречаются как при онкологических и так и патологических процессов, отражая нарушенное функционирование иммунной системы. Наблюдается увеличение встречаемости с возрастом; в бессимптомной популяции большинство случаев представлено гаммапатии неясного значения. Значение обнаружения парапротеинемии (ПП) в популяции приведено ниже:
MGUS(без прогресса за 5 лет)
Транзиторное (пожилой возраст)
Парапротеин может быть выявлен в сыворотке крови с помощью электорофореза белков сыворотки, количественного определения основных классов иммуноглобулинов сыворотки, а также с помощью метода иммунофиксации. Несомненным преимуществом выполняемого нами метода является проведение одновременного анализа сыворотки и мочи..
Особую важность в дифференциальной диагностике злокачественных и доброкачественных состояний является обнаружение фрагментов иммуноглобулинов, которые секретируются злокачественными клетками. Фрагменты иммуноглобулинов (легкие цепи) могут быть обнаружены в моче благодаря концентрирующему эффекту, но обычно не определяются при электрофорезе белков сыворотки. Таким фрагментом иммуноглобулина является белок Бенс-Джонса (ББД), представляющий агрегаты легких цепей иммуноглобулинов. При доброкачественных парапротеинемиях ББД в моче не обнаруживается, что позволяет использовать его выявление в качестве основного метода скрининга миеломы.
Концентрации Ig сыворотки
Болезнь тяжелых цепей альфа/гамма/мю
Тест 01.02.15.340 Легкие цепи иммуноглобулинов каппа и лямбда в сыворотке крови
При миеломе легкие цепи иммуноглобулинов отражают синтез парапротеина при большинстве типов парапротеинемий. Концентрация в крови может оставаться нормальной, но обычно повышена. Целесообразно подсчитать суточную экскрецию свободных легких цепей в моче. Для каппа цепи в норме она меньше чем 0,1 гр за 24 часа.. Увеличение свидетельствует о высокой вероятности парапротеинемии и требует обследования с помощью иммунофиксации.
Тест 01.02.15.420 Скрининг парапротеинемий методом иммунофиксации с в сыворотке крови (количественная оценкая парапротеина)
Данный метод представляет разновидность иммунофиксации, при которой белки сыворотки разделяются с помощью электрофореза, а на отдельной электрофоретической дорожке проводится иммунофиксация с антисывороткой направленной против тяжелых цепей IgG, IgM, IgA и легких цепей иммуноглобулинов. При наличии подозрения на присутсвие парапротеина (моноклональной полосы) в электрофореграмме, скрининговый иммунофиксационный метод позволяет обнаружить наличие парапротеина и расчитать его количество. Благодаря низкой цене метод скрининга более удобен для обследования как в целях дифференциальной диагностики парапротеинемий, так и наблюдения за динамикой парапротеина на фоне лечения моноклональных гаммапатий.
Тест 01.02.15.640 Скрининг белка Бенс-Джонса в крови с помощью иммунофиксации (разовая и суточная моча)
Выявление белка Бенс-Джонса позволяет отличить моноклональную гаммапатию невыясненного значения и злокачественную парапротеинемию на фоне онкогематологических заболевания, с высокой вероятностью диагностирует миелому легких цепей. Позволяет оценить содержание легких цепей (и их аггрегатов) в моче.
Тест 01.02.15.650 Скрининг гаммапатий в сыворотке и моче (два материала)
Комбинированное исследование позволяет исключить диагноз парапротеинемии (и моноклональной гаммапатии) при неясной клинической картине.
Тест 01.02.15.655 Типирование парапротеина в сыворотке крови с помощью иммунофиксации (IgG, IgA, IgM, каппа, лямбда)
с количественным исследованием парапротеина
В процессе этого метода белки сыворотки и мочи одновременно разделяются с помощью электрофореза и окрашиваются соотвествующими антисыворотками. Проводится денситометриеская оценка моноклонального компонета (парапротеина) и определяется его содержанию в г/л. Вероятность множественной миеломы значительно повышается при определении парапротеина более 3 гр/л. Тест позволяет одновременно сопоставить клональность иммуноглобулинов в сыворотке и моче.
Тест 01.02.15.645 Типирование белка Бенс-Джонса с помощью иммунофиксации (разовая и суточная моча)
Исследование позволяет определить наличие и типировать белок Бенс-Джонса в моче с панелью специфических антисывороток.
источник
Исследование позволяет выявить белок Бенс-Джонса в моче и типировать его с применением панели специфических антисывороток.
Белок Бенс-Джонса — чаще представлен свободными легкими цепями каппа, реже лямбда-цепями. Этот маркер при миеломе имеет не только диагностическое, но и прогностическое значение. При обнаружении белка Бенс-Джонса в моче необходимо его типирование, оценка соотношения каппа- и лямбда-цепей для оценки рисков и вероятных механизмов патогенного воздействия на почки. Патогенное действие белка Бенс-Джонса типа лямбда выше, чем белка типа каппа.
Треть больных с множественной миеломой страдает почечной недостаточностью и это может быть главным проявлением начала заболевания. Это вызвано выделением в мочевом осадке белковых цилиндров, причиной появления которых есть белок Бенс-Джонса. Он может взаимодействовать с такими белками мочи как белок Тамма-Хорсфалла. Основным проявлением миеломного поражения почек есть тубулярная атрофия. Почечная недостаточность при множественной миеломе возникает на фоне таких заболеваний, как дегидратация, гиперкальциемия, гиперурикемия, инфекция мочевыводящего тракта (ИМТ), а также после приема нефротоксических препаратов. Множественной миелома сопровождается выраженным склерозом интерстиция почки.
Другой формой поражения почек является первичный амилоидоз почек, сопровождающийся отложением в мезангии клубочков (соединительная ткань между капиллярными петлями клубочка) полимеров свободных легких цепей совместно с белками сыворотки, например, сывороточным амилоидом P. Основным проявлением амилоидоза почек служит выраженный нефротический синдром, а также отложения амилоида в ряде органов. В трех четвертях случаев причиной амилоидоза является продукция свободной легкой цепи лямбда.
Еще одна разновидность поражения почек — болезнь отложения легких цепей, при которой формирование амилоида не происходит, однако наблюдается быстрое снижение функции почек.
Поражение канальцев при миеломе может сопровождаться развитием вторичного синдрома Фанкони с нормогликемической глюкозурией, аминоацидурией, фосфатурией и проксимальным канальцевым ацидозом с мышечной слабостью и остеомаляцией. Часто этому сопутствует экскреция белка Бенс-Джонса типа каппа.
Показания:
- подозрение на миелому, амилоидоз почек (целесообразно назначение в комплексе с электрофорезом и иммунофиксацией белков сыворотки крови, а также измерением концентрации основных классов иммуноглобулинов в сыворотке);
- определение преимущественной секреции каппа или лямбда легкой цепи для оценки рисков и вероятных механизмов патогенного действия на почки при миеломе.
Подготовка
Накануне сдачи анализа не рекомендуется употреблять в пищу овощи и фрукты, которые могут изменить цвет мочи (свёкла, морковь, клюква и т.п.), принимать диуретики.
Собирают строго утреннюю порцию мочи, выделенную сразу же после сна. Перед сбором мочи необходимо провести тщательный гигиенический туалет внешних половых органов. При первом утреннем мочеиспускании небольшое количество мочи (первые 1–2 сек) выпустить в унитаз, затем собрать всю порцию мочи в чистую ёмкость, не прерывая мочеиспускания. Мочу отлить в стерильный пластиковый контейнер с завинчивающейся крышкой приблизительно 50 мл. Во время сбора мочи желательно не касаться контейнером тела. Доставить контейнер с мочой в медицинский офис необходимо в течение 2 часов с момента взятия биоматериала.
Женщинам не рекомендуется сдавать анализ мочи во время менструации.
Интерпретация результатов
Единицы измерения: г/л.
Результат сопровождается комментариями по интерпретации.
Референсные значения: белка Бенс-Джонса не обнаружено.
В норме в моче белок Бенс-Джонса не отмечается, его выявление указывает на вероятность серьезного гемато-онкологического заболевания. Присутствие белка Бенс-Джонса в моче является диагностическим маркером, характерным для множественной миеломы (выявляется в 2/3 всех случаев) и родственных заболеваний группы плазмоклеточных дискразий, указывает на высокий риск поражения органов-мишеней, включая миеломное поражение почек с формированием почечной недостаточности, литических изменений костей и анемии. Патогенное действие белка Бенс-Джонса типа лямбда выше, чем белка типа каппа.
Результат может быть ложноположительным в случае редких аутоиммунных процессов, сопровождающихся выраженной иммунной активацией, например, при СКВ или ревматоидном артрите. При доброкачественных парапротеинемиях белок Бенс-Джонса обычно не выявляется.
источник
Уважаемые пациенты! В октябре детская медицинская сестра принимает — 10, 11, 16, 17, 19 и 26 числа.
Лабораторная диагностика парапротеинемий.
Для клинического исследования парапротеина (ПП) целесообразно использовать электрофорез в агарозном геле или капиллярный электрофорез. В зависимости от условий электрофореза и состава буфера может формироваться 5 или 6 фракций белков. В последнем случае бета-фракция разделяется на бета-1 и бета-2 (минорную) фракции. В каждой фракции в норме присутствует определенный набор белков, поэтому результат электрофореза белков сыворотки дает комплексное представление об изменении синтеза и катаболизма многих белков организма (рис. 1). Клиническая интерпретация результатов электрофореза белковых фракций изложена в ряде руководств по клинической лабораторной диагностике.
Рис. 1. Основные фракции белка сыворотки крови и их компоненты
Для выявления ПП методы электрофореза и иммунофиксации должны использоваться совместно. Электрофорез с денситометрической оценкой белковых фракций позволяет предположить наличие ПП, а иммунофиксация – подтвердить его наличие в той или иной фракции. Денситометрия является предпочтительным методом оценки содержания белка в составе белковых фракций и позволяет оценить концентрацию ПП. Предел чувствительности метода электрофореза, ассоциированного с иммунофиксацией, позволяет определять 0,5 г/л моноклонального ПП в составе иммуноглобулина.
Классический результат обнаружения ПП с помощью электрофореза представляет выраженную полосу (М-пик) в зоне гамма-глобулинов. Интенсивная фракция ПП выявляется на бледном фоне, который указывает на подавление синтеза поликлональных иммуноглобулинов. Только в этой ситуации с большой уверенностью можно интерпретировать полученный результат как ПП и определить его концентрацию. Здесь иммунофиксация позволяет типировать ПП, т. е. описать его состав. В большинстве же случаев выявление моноклонального ПП в образце не так однозначно (рис. 2), т. к. ПП происходит из поликлональных молекул иммуноглобулинов, которые обладают разными физико-химическими свойствами и могут мигрировать в составе различных фракций белков сыворотки.
Рис. 2. Детекция парапротеина с помощью электрофореза белков сыворотки и основные феномены, затрудняющие его выявление.
Чаще всего ПП класса IgG и IgM обнаруживаются в гамма-фракции, а ПП классов IgA и свободные легкие цепи мигрируют в составе альфа2- и бета-фракций. Нарушение синтеза иммуноглобулинов затрудняет выявление ПП при поликлональной гипергаммаглобулинемии (рис. 2.7), увеличение продукции IgA при циррозе (рис. 2.5), олигоклональный синтез иммуноглобулинов при хронических воспалительных заболеваниях. Гипоглобулинемия может быть проявлением миеломы Бенс-Джонса с угнетением синтеза собственных иммуноглобулинов (рис. 2.8). В последнем случае свободные легкие цепи обычно мигрируют в составе бета- или альфа2-фракции глобулинов. Изменения альфа2- и бета-фракций могут имитировать присутствие ПП. Дополнительные яркие полосы отмечаются в гамма-фракции при высоком содержании фибриногена в сыворотке (рис. 2.4), гемолизе с образованием комплексов “гемоглобин – гаптоглобин” в альфа2-фракции (рис. 2.3). Увеличение и изменение бета-фракции происходит при повышении трансферрина при железодефицитной анемии, выявлении генетических вариантов трансферрина, высокого С-реактивного белка или С3-фактора комплемента при воспалении. Подозрения на ПП могут возникать при нарушениях метаболизма при нефротическом синдроме (рис. 2.6) или индукции синтеза белков, например альфа-фетопротеина при раке печени.
Стандартного алгоритма для проведения иммунофиксации по результатам электрофореза белков сыворотки крови нет, поэтому решение о проведении дообследования клиницист и врач клинической лабораторной диагностики должны принимать совместно в зависимости от клинических находок и результатов лабораторных показателей. Обнаружение даже небольшого содержания ПП может указывать на тяжелое онкогематологическое заболевание, такое как лимфома или миелома. Определение свободных легких цепей иммуноглобулинов и их соотношения может использоваться в качестве дополнительного метода в постановке диагноза, однако такая оценка неточна при биклональной миеломе и небольшом содержании ПП (менее 5 г/л). Поэтому увеличение глобулиновых фракций сыворотки крови (альфа2, бета, гамма) требует проведения иммунофиксации. Гипогаммаглобулинемия, особенно в сочетании с протеинурией, является основным признаком миеломы Бенс-Джонса. В случае гипогаммаглобулинемии должен быть выполнен электрофорез 24-часовой мочи для обнаружения белка Бенс-Джонса.
Иммунофиксация является двустадийным процессом, который объединяет горизонтальный электрофорез в агарозном геле и детекцию иммуноглобулинов с помощью специфических антисывороток. Моноспецифические антисыворотки к тяжелым и легким цепям иммуноглобулинов наносятся на гель и проникают в его структуру за счет пассивной диффузии. Благодаря малой толщине геля линии преципитации антисыворотки иммуноглобулина образуются сравнительно быстро (через 20–30 мин), однако эффективность преципитации зависит от ряда факторов, включая концентрацию антигена, ионную силу и рН раствора, а также температуру. Образовавшиеся иммунные комплексы являются нерастворимыми и фиксируются в порах геля. Отмывка позволяет удалить несвязавшиеся белки, а иммунные комплексы окрашиваются белковым красителем.
Иммунофиксация производится одновременно на 6 дорожках, из которых в одну вносится фиксатор белков, в пять остальных – антисыворотки к тяжелым цепям IgG, IgA, IgM и легким цепям каппа и лямбда. Обнаружение характерной фракции белка, которая реагирует с антисыворотками против тяжелых и легких цепей, указывает на обнаружение ПП, представленного целой молекулой одного из основных классов иммуноглобулинов. Если фракция реагирует только с антисывороткой против легкой цепи, то рекомендуется повторное исследование с антисыворотками к IgD и IgE. Отсутствие реакции с антисыворотками к IgD и IgE указывает на то, что ПП представлен свободной легкой цепью иммуноглобулина. Болезнь тяжелых цепей представляет редкий лабораторный диагноз, который должен устанавливаться только при очевидном выявлении изолированного синтеза тяжелой цепи иммуноглобулина. Следует учитывать, что миелома класса IgA может походить на болезнь тяжелых цепей, т. к. структура ПП IgA может затруднять распознавание легких цепей соответствующими антисыворотками. Примеры обнаружения ПП с помощью иммунофиксации приведены на рис. 3. При выявлении ПП необходимо сопоставить результат иммунофиксации с электрофорезом белковых фракций, провести денситометрическое выделение моноклональной фракции и ее измерение.
Рис. 3. Варианты выявления парапротеина методом иммунофиксации на системе SAS1/SAS2 фирмы Helena Biosciences Europe (Великобритания).
Высокое содержание ПП в патологических образцах часто приводит к феномену “прозоны”, который заключается в растворении иммунных комплексов при высокой концентрации антигена. Феномен прозоны может приводить к ложноотрицательным результатам тестирования. Для устранения этого явления может потребоваться повторное исследование с многократным разведением тестируемой сыворотки для снижения концентрации ПП в образце. Высокая концентрация иммунных комплексов, ревматоидного фактора, криоглобулинов может привести к преципитации в месте нанесения сыворотки на всех дорожках. В этом случае может потребоваться использование восстанавливающих веществ, например 2-меркаптоэтанола, для растворения агрегатов и повтора исследования.
Удобным вариантом сочетания методов электрофореза белков сыворотки и иммунофиксации является исследование с пентавалентной антисывороткой. Это скрининговый метод, представляющий разновидность иммунофиксации с использованием одной антисыворотки, направленной против IgG, IgM, IgA, каппа и лямбда цепей. Окраска амидо-черным красителем позволяет проводить прямую денситометрию белковых фракций и одновременную количественную оценку ПП на основании выявленных моноклональных фракций. Этот метод не только позволяет проводить скрининговое обследование, но и сравнительно дешевле развернутого теста, т. к. вместо 6 используются только 2 дорожки.
Для выполнения клинического электрофореза и проведения иммунофиксации в нашей лаборатории с 2008 г. мы пользуемся системой клинического электрофореза SAS-1plus/SAS-2 и готовыми наборами реактивов фирмы Helena Biosciences Europe (Великобритания). Все реактивы для электрофореза объединены в системе “гель – буфер”, что исключает необходимость работы с буфером для электрофореза. На один гель может быть нанесено до 24 образцов, причем система нанесения образцов позволяет комбинировать образцы различного биологического материала, что целесообразно при одновременном проведении иммунофиксации образцов сыворотки крови и мочи. Заслуживает отдельного внимания уникальная система автоматического нанесения образцов на гель, которая может сконцентрировать биоматериал непосредственно на геле. За счет этого метод имеет высокую аналитическую чувствительность, составляющую 0,25 г/л белка на белковую фракцию сыворотки и до 10 мг/л на фракцию белков мочи. Электрофорез проводится в реакционной камере при постоянной температуре и влажности. Вся процедура фиксации, окрашивания и сушки геля стандартизована, выполняется в автоматическом режиме и не требует вмешательства персонала. Для обработки, редактирования, анализа и архивирования данных, а также ведения карт внутрилабораторного контроля качества используется русифицированный пакет программного обеспечения Platinum III. Его дополнительным преимуществом является возможность создания удобной формы заключения по результатам исследования, а также интегрирование в лабораторную информационную систему.
источник
Скрининг миеломной болезни и парапротеинемий (иммунофиксация сыворотки крови с пентавалентной сывороткой)
Данный тест предназначен для обнаружения моноклонального иммуноглобулина (парапротеина) с помощью сочетания таких методов, как клинический электрофорез и иммунофиксация. В результате разделения белков сыворотки крови путем электрофореза парапротеин (также его называют М-пиком Или М-градиентом) претерпевает миграцию в виде компактной полосы, что делает его заметным на фоне других белков фракций. Метод иммунофиксации позволяет достоверно выявить моноклональный иммуноглобулиновый компонент и определить его абсолютное содержание в сыворотке крови.
Электрофоретическое разделение белков сыворотки крови, клинический электрофорез и иммунофиксация, скрининг болезни Рустицкого-Калера, скрининг миеломы, скрининг миеломатоза, скрининг ретикулоплазмоцитоза, скрининг генерализованной плазмоцитомы.
Синонимы английские
Serum protein electrophoresis , immunofixation electrophoresis, multiple myelomascreening, plasmacellscancerscreening, plasmacell myeloma screening, monoclonal gammopathy screening.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Диагностика миеломной болезни проводится с помощью симбиоза двух методов исследования – клинического электрофореза и иммунофиксации – и заключается в выявлении присутствия парапротеина в сыворотке крови для его последующего типирования. С помощью данного исследования можно выявить не только миеломную болезнь, но и другие лимфопролиферативные заболевания, а также амилоидоз, полинейропатию, гемолитические анемии, криоглобулинемию, поражения почек.
Основным признаком данных заболеваний с точки зрения лабораторной диагностики является увеличение синтеза иммуноглобулина. Метод электрофореза позволяет разделить белки сыворотки крови и выделить иммуноглобулин – в результате расщепления он выделяется на фоне других белковых фракций в виде мигрирующей полосы. Этот иммуноглобулин называется парапротеином (также его называют моноклональным иммуноглобулином, М-пиком или М- градиентом). Именно он является онкомаркером при наличии у пациента гематоонкологических заболеваний.
Клинические проявления миеломной болезни связаны с разрушением костей – это могут быть патологические переломы, боли в костях, анемический синдром, снижение гемоглобина в крови, синдром гипервязкости, тромбозы и кровотечения. Разрушение костей приводит к увеличению количества кальция в крови, что в свою очередь влечет за собой кальциевые отложения в почках, легких и на слизистой желудка. Также при миеломной болезни наблюдаются частые бактериальные инфекции у пациента – это связано с падением количества нормальных иммуноглобулинов и нарушениями процесса образования антител.
Наличие множественной миеломы напрямую связано с пролиферацией плазмацитов, способных секретировать парапротеин или его фрагменты. На момент диагноза концентрация моноклонального иммуноглобулина в сыворотке крови чаще всего превышает 25 г/л. Контроль и наблюдение за изменением уровня концентрации парапротеина позволяет проводить мониторинг состояния пациента и оценку эффективности лечения миеломы. При наличии заболевания контрольные анализы для наблюдения за изменением уровня концентрации парапротеинана на фоне терапии должны проводиться каждые 3 месяца.
При миеломе парапротеин в сыворотке крови в 60 % случаев представлен IgG, 20 % приходится на IgA. Эти 20 % относятся к определению миеломы Бенс-Джонса – в этом случае необходимо также проконтролировать продукцию свободных легких цепей (каппа или лямбда) и их наличие в моче. Достаточно редко (в 2–4 % случаев) при наличии миеломы может также отмечаться присутствие биклонального парапротеина.
Лимфома, при которой активно продуцируется моноклональный IgM, называется макроглобулинемией Вальденстрема. При данном типе лимфомы опухолевые клетки диффузно распределяются в селезенке, костном мозге и лимфоузлах. Увеличивается вязкость крови и проявляется ряд клинических симптомов: слепота, спутанность сознания, склонность к кровоточивости, гипертензия, сердечная недостаточность – это связано с повышением концентрации моноклонального IgM до 30 г/л и более. При других типах лимфомконцентрация парапротеинов класса IgM обычно не превышает 30 г/л, хотя они и обнаруживаются у 20 % пациентов.
Помимо перечисленного, моноклональный парапротеин может быть обнаружен при некоторых неопухолевых заболеваниях. Это может быть эссенциальная криоглобулинемия, парапротеинемическая хроническая полинейропатия, холодовая гемолитическая анемия, АL-амилоидоз почек и внутренних органов, болезнь отложения легких цепей. Также парапротеин в сыворотке крови обнаруживается при болезни Кастелмана, POEMS-синдроме и микседематозном лишае.
В случае если парапротеинемия не прогрессирует во множественную миелому или другое заболевание в течение 5 лет, речь идёт о доброкачественной парапротеинемии. В этом случае концентрация парапротеина обычно ниже 3 г/л.
Согласно статистике, парапротеинемия чаще всего выявляется у пациентов старше 50 лет. У лиц старше 65 лет выявляемость заболевания достигает 4-10 %. В большинстве случаев это бессимптомные моноклональные гаммапатии невыясненного значения (МГНЗ) – это парапротеинемия без других признаков онкогематологического заболевания. В этом случае не требуется постоянный мониторинг концентрации.
При выявлении парапротеинемии у пациентов моложе 50 лет необходимо проводить контрольные повторные обследования. Это связано с повышенным риском развития множественной миеломы. В случае обнаружения концентрации парапротеина выше 15 г/л необходимо провести ряд дополнительных исследований: электрофорез 24-часового образца мочи и иммунофиксация каждые 3-6 месяцев.
Для чего используется исследование?
- Диагностика причины клинической симптоматики (болей в спине, спонтанных переломов, частых бактериальных инфекций, полиневрита, гемолитической анемии, нефротического синдрома, кожной пурпуры, синдрома повышенного СОЭ, гиперкальциемии, амилоидоза внутренних органов, эндокринопатии, органомегалии).
- Мониторинг уровня концентрации парапротеинов при моноклональнойгаммапатии невыясненного значения.
- Оценка эффективности проводимой терапии при миеломе и других гаммапатиях.
Референсные значения: парапротеина (IgG, A, M, каппа/лямбда) не обнаружено.
Парапротеин в сыворотке крови присутствует в случае наличия у пациента:
- транзиторной парапротеинемии;
- моноклональной гаммапатии невыясненного значения;
- доброкачественной парапротеинемии;
- парапротеинемической полинейропатии;
- криоглобулинемии;
- холодовой гемолитической анемии;
- AL-амилоидоза или болезни отложения легких цепей;
- миседематозного лишая;
- POEMS-синдрома (полинейропатии с органомегалией);
- множественной миеломы;
- макроглобулинемии Вальденстрема;
- лимфомы и ХЛЛ (хронического лимфолейкоза);
- болезни тяжелых цепей.
Отсутствие парапротеина в сыворотке крови позволяет практически полностью исключить вероятность диагноза «гаммапатия» (для подтверждения необходимо исключить присутствие белка Бенс-Джонса в моче).
Интерпретация результатов исследования не является диагнозом и содержит информацию для лечащего врача для использования информации наряду с другими источниками (анамнеза, истории болезни, других исследований).
[40-063] Клинический и биохимический анализ крови — основные показателиКто назначает исследование?
Онколог, терапевт, гематолог, нефролог, уролог.
1. Лапин С.В. Тотолян А.А. Иммунологическая лабораторная диагностика аутоиммунных заболеваний. Издательство»Человек», СПб- 2010.
2. Tietz Clinical guide to laboratorytests. 4-th ed. Ed. Wu A.N.B.- USA,W.B Sounders Company, 2006,1798 p.
3. Conrad K, Schlosler W., Hiepe F., Fitzler M.J. Autoantibodies in Organ Specific Autoimmune Diseases: A Diagnostic Reference/ PABST, Dresden – 2011.
4. Conrad K, Schlosler W., Hiepe F., Fitzler M.J. Autoantibodies in Systemic Autoimmune Diseases: A Diagnostic Reference/ PABST, Dresden – 2007.
5. Gershvin ME, Meroni PL, Shoenfeld Y. Autoantibodies 2 nd ed./ Elsevier Science – 2006.
6. Shoenfeld Y., Cervera R, Gershvin ME Diagnostic Criteriain Autoimmune Diseases / Human Press – 2008.
источник
В плазме человеческой крови находится множество белковых компонентов. Они различны по своему составу, строению и подвижности в определенной среде, проводящей электрический ток. На этом и строится разделение общего белка, который локализуется в плазме, на различные белковые фракции. При проведении электрофореза сыворотки крови выясняют количественное отношение отдельных белковых составляющих и структур. Это необходимо для определения наличия у человека различных патологических явлений, например инфекций или онкологии. Именно электрофорез белков сыворотки крови имеет большое значение при проведении диагностики различных болезней.
Для расщепления белковых фракций применяют электрофорез сыворотки крови, принцип которого основан на разной подвижности белковых компонентов в созданном электрическом поле. Такой метод исследования является более точным и информативным, в отличие от стандартного общего анализа крови. Но при этом электрофорез показывает только количество определённой фракции белка, характер и степень патологического процесса в общей форме. Анализ проведенных исследований позволяет медицинским специалистам выяснить, какое именно соотношение белковых фракций наблюдается в организме человека, и определить специфику патологии, присущую конкретному заболеванию.
Большую часть основной биологической жидкости человека, или крови, составляют белки. В общем количестве их норма находится в пределах 60-80 г/л. Для получения точного анализа проводится электрофорез сыворотки крови на бумаге. Это исследование является самым распространенным способом анализа. Основной средой является особая фильтровальная бумага. Главная ее особенность – высокая гигроскопичность. Такая бумага может поглотить воды больше своего веса в 130-200 раз. В зависимости от применяемого оборудования электрофорез на бумаге длится 4-16 часов. Происходит подразделение белковых структур. Затем полосы бумаги обрабатывают специальными красками для получения анализа. Такая методика является самой распространенной в работе медицинских лабораторий. За счёт воздействия электрического тока белковые фракции, заряженные отрицательно, двигаются в сторону положительно заряженного электрода. Благодаря этому белковые составляющие крови подразделяются на 5 известных фракций:
Альбумины заряжены отрицательно, имеют маленькую, по сравнению с другими фракциями, молекулярную массу. За счет этого скорость их передвижения гораздо выше, чем у остальных фракций, и они дальше всех локализуются от участка старта. Первые три фракции глобулина передвигаются с более низкой скоростью из-за своей массы. Но самая маленькая скорость регистрируется у γ-глобулинов. Эти белки имеют большую массу и крупные, относительно других, размеры. Их заряд почти нейтрален, поэтому данная белковая фракция практически не сдвигается с линии старта.
В настоящее время электрофорез сыворотки крови часто проводимый анализ для постановки точного диагноза болезни. Этот анализ могут назначить как терапевты, так врачи узкого профиля. Показаниями по проведению исследований будут:
- различные воспаления;
- болезни хронической природы;
- патологические процессы в соединительной ткани;
- внутреннее кровотечение;
- злокачественные новообразования.
Для того чтобы полученные результаты поведенных исследований были верными, не менее чем за 8 часов до сдачи крови необходимо отказаться от приёма еды. Кроме того, необходимо согласовать прием лекарственных средств, если таковые имеются, с лечащим врачом.
Для того чтобы результаты не были по ошибке завышены, необходимо снизить до минимума возможность свертывания крови для определения показателя белковых фракций и общего белка. Электрофорез сыворотки крови проводится аккуратно, поскольку существует вероятность искажения полученных результатов из-за фибриногена. Он может прятать ненормальные белки или быть спутанным с ними.
В течение суток после сдачи пробы будет готов анализ на электрофорез белков сыворотки крови. Норма полученных показателей по категориям у взрослых людей:
- Общий белок – 63-82 г/л.
- Альбумины – 40-60 % от общего количества фракций.
- α1-глобулины – 2-5 %.
- α2-глобулины – 7-13 %.
- β-глобулины – 8-15 %
- γ-глобулины – 12-22 %.
Изменение количества любой белковой фракции в большую или меньшую сторону может свидетельствовать о развитии той или иной патологии. Для получения достоверной информации об этом необходим электрофорез белков сыворотки крови. Расшифровка результатов облегчит медицинским специалистам постановку диагноза и выбор лечения.
В самом начале при анализе полученных результатов определяют количество альбумина. Увеличение этой фракции может говорить об обезвоживании. Такое может произойти, если у больного отмечается затяжная рвота или нарушения в пищеварительной системе. Также увеличение альбумина происходит при ожогах большой площади кожного покрова.
Гораздо опаснее, если в организме снижается количество альбуминов, это может говорить о следующих патологиях:
- Поражения почек и печени.
- Патологии желудочно-кишечного тракта.
- Инфекционные процессы.
- Нарушения в деятельности сердечно-сосудистой системы.
- Кровотечения.
- Злокачественные новообразования.
- Сепсис.
- Ревматизм.
Незначительное уменьшение количества альбуминов может быть также:
- У будущих матерей.
- При превышении дозы лекарственных препаратов.
- При длительной лихорадке.
- У заядлых курильщиков.
Уменьшение количества a1-глобулинов регистрируется при недостатке α1-антитрипсина. Увеличение же отмечают при обострении воспалений в организме, нарушениях в работе печени, при тканевом распаде.
Регистрируют его при сахарном диабете, воспалительных процессах в поджелудочной железе, у новорожденных детей при желтухе, при гепатитах токсического происхождения. Свидетельствует оно и о неправильном, несбалансированном питании.
Происходит при наличии следующих заболеваний:
- Воспаления, особенно с присутствием гнойного экссудата (воспаление легких и другие процессы с наличием гноя).
- Поражения соединительной ткани (например, ревматизм).
- Злокачественные новообразования.
- Периоды восстановления после ожогов.
- Поражение почек.
Кроме того, такое явление характерно для гемолиза крови в пробирке во время проведения исследования.
Проявляется при гиперлипопротеидемии (увеличении количества липидов в крови), патологиях печени и почек. Можно обнаружить при открытой язве желудка, а также гипотиреозе (нарушение работы щитовидной железы). Снижение фракции регистрируют при гипобеталипопротеинемии (повышение в крови компонента беталипопротеин).
Эта фракция включает в свой состав иммуноглобулины. Поэтому увеличение γ-глобулинов регистрируется при сбоях в иммунитете. Обычно это происходит при различных инфекциях, развитии воспалительного процесса, изменениях ткани и ожоговых поражениях. Рост γ-глобулинов отмечают у больных хронической формой гепатита. Практически такая же картина характерна для цирроза печени. При запущенных случаях данного заболевания количество белковой фракции γ-глобулинов значительно выше показателя альбуминов. При определенных болезнях могут возникать сбои в образовании γ-глобулинов, и происходит развитие измененных протеинов в крови – парапротеинов. Для выяснения характера такого развития производится дополнительное исследование – иммуноэлектрофорез. Такая картина характерна для миеломного заболевания и патологии Вальденстрема.
Увеличение количества γ-глобулинов также присуще следующим патологиям:
- красной волчанке;
- эндотелиоме;
- ревматоидной форме артрита;
- остеосаркоме;
- хронической форме лимфолейкоза;
- кандидомикозу.
Снижение показателя γ-глобулинов подразделяют на 3 вида:
- Физиологический (характерен для детей в возрасте от трех до пяти месяцев).
- Врожденный (развивается с момента рождения).
- Идиопатический (когда причину развития установить не удается).
Вторичное снижение регистрируется при развитии заболеваний, которые вызывают истощение иммунной системы. В последнее время в медицинской практике все чаще проводится анализ на определение количества преальбуминов. Обычно такое исследование проводят больным, находящимся в реанимации.
Уменьшение количества преальбуминов очень важный и точный тест на определение недостаточности белковых структур в организме пациента. При проведении анализа на преальбумины выполняют коррекцию белкового метаболизма у таких пациентов.
Принцип проведения подобного анализа схож с технологией выполнения электрофореза сыворотки крови. Проводят его для более точной постановки диагноза или обнаружения других патологий. Кроме того такой анализ поможет выявить у больного наличие протеинурии.
Электрофорез сыворотки крови и мочи – важные методы в диагностике различных инфекционных заболеваний. Благодаря методике исследования и высокой точности они помогают определить вид патологии. Точный диагноз – верный путь к правильному лечению и полному выздоровлению.
источник
МИЕЛОМА, МНОЖЕСТВЕННАЯ МИЕЛОМА, МИЕЛОМНАЯ БОЛЕЗНЬ, СЕКРЕТИРУЮЩАЯ ЛИМФОМА, ПЛАЗМАЦИТОМА, БОЛЕЗНЬ РУСТИЦКОГО и т.д. – все это синонимы одного заболевания, которое обусловлено неконтролируемым ростом плазматических клеток, продуцируемым костным мозгом. Плазматические клетки, в свою очередь, являются конечной стадией дифференциации В-лимфоцитов – основного звена клеточно-гуморального иммунитета, основная функция которых – продукция иммунных белков – иммуноглобулинов IgG, IgA, IgM, IgE, IgD, участвующих в гуморальном иммунитете. Поэтому в норме костный мозг всегда содержит некоторое количество плазматических клеток. Однако, в случае их неконтролируемого роста увеличение количества плазматических клеток приводит к их сосредоточению в виде плазмацитомы в костном мозге, особенно в позвоночном столбе, тазовых костях, ребрах, плоских костях черепа, головках тазобедренных суставов, в результате чего нормальная костная ткань и костный мозг разрушаются. Очаги деструкции видны при рентгеновском исследовании, но, к сожалению, разрешающая способность рентгена позволяет выявить разрежение костной ткани, если порядка 30% ее уже разрушено. Миеломные клетки продуцируют иммуноглобулин одного вида (моноклональный), который при специфическом электрофоретическом исследовании сыворотки крови и мочи проявляется пиком, называемым М-градиентом, где М — означает моноклональный или миеломный. Отсюда происходит название болезни – миелома. Моноклональные белки (протеины), продуцируемые миеломными клетками, имеют измененную структуру, не выполняют функций иммунитета и называются «парапротеинами». Иногда они теряют какую-то свою часть и могут продуцироваться только моноклональные легкие цепи (белок Бенс-Джонса), или моноклональные тяжелые цепи.
(ДИАГНОСТИКУ МИЕЛОМНОЙ БОЛЕЗНИ СМ. ВНИЗУ СТРАНИЦЫ)
* — скидка 3% при оформлении заказа на сайте
Неконтролируемый рост плазматических клеток приводит к множеству тяжелых последствий, из которых наиболее характерные:
- Разрушение костной ткани скелета;
- Нарушения кроветворения в костном мозг;
- Увеличение вязкости крови из-за большого количества парапротеинов;
- Снижение иммунитета из-за подавления продукции нормальных иммуноглобулинов;
- Развитие почечной недостаточности из-за оседания нарушений в почечных клубочках и канальцах;
Миеломная болезнь может развиваться долгое время бессимптомно, но становится понятным, почему одними из первых характерных клинических симптомов Миеломы являются:
- Боли различной интенсивности в нижней части спины, ребрах или других участках скелета;
- Анемия, сопровождающаяся одышкой, слабостью, потерей зрения, болями в области сердца;
- В крови наблюдается повышенное СОЭ;
- Повышение содержания кальция в крови и моче из-за разрушения костной ткани;
- Появляется белок в моче, что приводит к серьезным нарушениям функции почек, особенно опасно появление белка Бенс-Джонса.
Понятно и то, что из-за незнания о существовании такого заболевания пациент идет к врачам другого профиля и часто теряет драгоценное время из-за отсутствия целенаправленного и компетентного обследования. Диагностика миеломной болезни зачастую проводится уже в последнюю очередь. Что еще хуже, с проблемами в костной ткани часто больные приходят к мануальным терапевтам, не зная, что миелома – это прямое противопоказание для мануальных процедур.
При наличии одного или нескольких из перечисленных выше симптомов абсолютно необходимо обследоваться в специализированной лаборатории для исключения миеломы, поскольку раннее выявление гарантирует успешное лечение. Следует помнить, что диагноз Миеломы не может быть установлен без результатов иммунохимической диагностики крови и мочи. Своевременная диагностика миеломной болезни – залог вашего выздоровления.
Если же диагностирована множественная миелома, то для пациентов с таким диагнозом нормальным поведением является систематическое рациональное обследование и определение прогностических факторов (бета2-микроглобулин в сыворотке крови и в моче, СРБ, белок Бенс-Джонса в моче, тип парапротеина), чтобы судить о развитии миеломы, ее агрессивности и контролировать эффективность выбранной схемы лечения. Такой контроль необходимо осуществлять не реже, чем 1 раз в 3 месяца во время лечения и 1 раз в 6-12 месяцев при стойкой ремиссии.
Пациенты должны также знать о том, что специализированная иммунохимическая диагностика Миеломы осуществляется только в трех медицинских учреждениях страны, одним из которых является «Иммунотест» — автор основных патентов и методик в этой области, постоянно обновляющий диагностическую базу современными методами, что создает оптимистичное будущее для больных Миеломой. Лечение миеломной болезни – это вполне реально, и шансы на выздоровление очень высоки, особенно на ранних стадиях. Успешное лечение миеломной болезни также во многом зависит от профессионализма лечащего врача, который, исходя из своих знаний и опыта, может прописать или порекомендовать действительно эффективное средство. Множественная миелома – это не приговор!
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Парапротеины в сыворотке крови в норме отсутствуют.
Иммуноглобулинопатии, или гаммапатии, объединяют большую группу патологических состояний, характеризующихся поликлональной или моноклональной гипергаммаглобулинемией. Иммуноглобулины состоят из двух тяжёлых (H) цепей (молекулярная масса 50 000) и двух лёгких (L) цепей (молекулярная масса 25 000). Цепи соединены дисульфидными мостиками и состоят из структур, которые называются доменами (Н — из 4, L — из 2 доменов). При действии протеолитических ферментов Ig разделяются на фрагменты: Fc-фрагмент и Fаb-фрагмент. Тяжёлые цепи Ig человека представлены пятью структурными вариантами, которые обозначают буквами греческого алфавита: γ, α, μ, δ, ε. Им соответствуют 5 классов Ig — G, A, M, D, E. Лёгкие цепи представлены двумя структурно различными вариантами: κ (каппа) и λ (лямбда), которым соответствуют два типа Ig каждого класса. В каждой молекуле Ig обе тяжёлые и обе лёгкие цепи идентичны. У всех людей в норме присутствуют Ig всех классов и обоих типов, но их относительное содержание неодинаково. Соотношение молекул κ и λ в пределах разных классов Ig также неодинаково. Выявление нарушения соотношений Ig или их фрагментов играет важнейшую роль в диагностике моноклональных иммуноглобулинопатий.
Моноклональная иммуноглобулинопатия (парапротеинемия) — синдром, выражающийся в накоплении в сыворотке крови и/или моче больных однородных по всем физико-химическим и биологическим параметрам Ig или их фрагментов. Моноклональные Ig (парапротеины, М-протеины) — продукт секреции одного клона В-лимфоцитов (плазматических клеток), поэтому представляют собой пул структурно гомогенных молекул, имеющих тяжёлые цепи одного класса (субкласса), лёгкие цепи одного типа и вариабельные области одинакового строения. Моноклональные иммуноглобулинопатии принято разделять на доброкачественные и злокачественные. При доброкачественных формах моноклональных гаммапатий пролиферация плазматических клеток контролируется (возможно, иммунной системой) таким образом, что клинические симптомы отсутствуют. При злокачественных формах происходит бесконтрольная пролиферация лимфоидных или плазматических клеток, которая и обусловливает клиническую картину заболевания.
Классификация моноклональных иммуноглобулинопатий
Категория оноклональных гаммапатий
Концентрация патологического Ig в сыворотке крови, г/л
Множественная миелома, макроглобулинемия Вальденстрёма
Плазмоцитома (солитарная — костная и экстрамедуллярная), лимфома, хронический лимфолейкоз, болезнь тяжёлых цепей
Иммуноэлектрофорез белков сыворотки крови позволяет выявлять моноклональные (патологические) IgA, IgM, IgG, цепи Н и L, парапротеины. При обычном электрофорезе нормальные Ig, разнородные по свойствам, располагаются в зоне γ, образуя плато или широкую полосу. Моноклональные Ig вследствие своей однородности мигрируют преимущественно в зону γ, изредка в зону β и даже в область α, где образуют высокий пик или чётко отграниченную полосу (М-градиент).
Множественная миелома (болезнь Рустицкого-Калера) — самый частый парапротеинемический гемобластоз; его выявляют не реже, чем хронические миело- и лимфолейкозы, лимфогранулематоз и острые лейкозы. Класс и тип секретируемых миеломой патологических Ig определяет иммунохимический вариант заболевания. Частота классов и типов патологических Ig при миеломе в целом коррелирует с соотношением классов и типов нормальных Ig у здоровых людей.
Наряду с повышением содержания патологических Ig в сыворотке больных множественной миеломой определяют нормальные Ig в сниженной концентрации. Содержание общего белка резко повышено — до 100 г/л. Активность процесса при G-миеломе оценивают по количеству плазмоцитов в стернальном пунктате, концентрации креатинина и кальция в сыворотке крови (их повышение кальция свидетельствует о прогрессировании заболевания). Концентрация М-протеина (в моче он называется белком Бенс-Джонса) служит критерием для оценки прогрессирования заболевания при А-миеломе. Концентрация парапротеинов в сыворотке и моче варьирует в течении болезни под воздействием терапии.
Для постановки диагноза множественной миеломы необходимо наличие следующих критериев.
- Плазмоцитома по результатам биопсии.
- Плазмоцитоз в красном костном мозге (более 30% клеток).
- Пики моноклональных (патологических) Ig при электрофорезе сывороточного белка: более 35 г/л для пика IgG или более 20 г/л для пика IgA. Экскреция κ и λ-цепей в количестве 1 г/сут и более, выявленная с помощью электрофореза мочи у больного без амилоидоза.
- Плазмоцитоз в красном костном мозге 10-30% клеток.
- Пик PIg в сыворотке крови в количестве меньшем, чем указано выше.
- Литические поражения костей.
- Концентрация нормального IgM ниже 0,5 г/л, IgA ниже 1 г/л или IgG ниже 0,6 г/л.
Для постановки диагноза множественной миеломы необходим как минимум 1 большой и 1 малый критерий или 3 малых с обязательным наличием критериев, приведённых в пунктах 1 и 2.
Для определения стадии миеломы используют стандартизирующую систему Дьюри-Сальмона, которая отражает объём опухолевого поражения.
Все группы миелом делятся на подклассы в зависимости от состояния функции почек: А — концентрация креатинина в сыворотке крови ниже 2 мг% (176,8 мкмоль/л), В — более 2 мг%. При миеломной болезни высокая концентрация β2-микроглобулина в сыворотке крови (более 6000 нг/мл) предполагает неблагоприятный прогноз, так же как и высокая активность ЛДГ (выше 300 МЕ/л, постановка реакции при 30 °C), анемия, почечная недостаточность, гиперкальциемия, гипоальбуминемия и большой объём опухоли.
Болезни лёгких цепей (миелома Бенс-Джонса) составляют приблизительно 20% случаев миелом. При миеломе Бенс-Джонса образуются исключительно свободные лёгкие цепи, которые выявляют в моче (белок Бенс-Джонса), при отсутствии сывороточного патологического Ig (М-градиента).
Стадии множественной миеломы
Масса опухоли (количество клеток), х10 12 /м 2
Малая миелома при наличии следующих критериев:
концентрация гемоглобина в крови выше 100 г/л;
концентрация общего кальция в сыворотке крови в норме ( 1,2
К редким иммунохимическим вариантам миеломной болезни относятся несекретирующая миелома, при которой парапротеины можно обнаружить только в цитоплазме миеломных клеток, а также диклоновые миеломы и М-миелома.
Макроглобулинемия Вальденстрёма — хронический сублейкемический лейкоз В-клеточной природы, морфологически представленный лимфоцитами, плазмоцитами и всеми переходными формами клеток, синтезирующими РIgМ (макроглобулин). Опухоль обладает низкой степенью злокачественности. В красном костном мозге обнаруживают пролиферацию мелких базофильных лимфоцитов (плазмацитоидных лимфоцитов), повышено количество тучных клеток. На электрофореграмме белков сыворотки крови выявляют М-градиент в зоне β- или γ-глобулинов, реже парапротеин не мигрирует в электрическом поле, оставаясь на месте. Иммунохимически он представляет РIgМ с одним типом лёгких цепей. Концентрация РIgМ в сыворотке крови при макроглобулинемии Вальденстрёма колеблется от 30 до 79 г/л. У 55-80% больных обнаруживают белок Бенс-Джонса в моче. Концентрация нормальных Ig в крови снижается. Почечная недостаточность развивается нечасто.
Лимфомы. Наиболее часто регистрируют IgM-секретирующие лимфомы, второе место занимают парапротеинемические лимфомы, секретирующие IgG, лимфомы с IgA-парапротеинемией выявляют крайне редко. Снижение концентрации нормальных Ig (обычно в небольшой степени) при лимфомах регистрируют у большинства больных.
Болезни тяжёлых цепей — В-клеточные лимфатические опухоли, сопровождающиеся продукцией моноклональных фрагментов тяжёлых цепей Ig. Болезни тяжёлых цепей наблюдают очень редко. Существует 4 разновидности болезни тяжёлых цепей: α, γ, μ, δ. Болезнь тяжёлых цепей γ обычно возникает у мужчин моложе 40 лет, характеризуется увеличением печени, селезёнки, лимфатических узлов, отёком мягкого неба и языка, эритемой, лихорадкой. Деструкция костей, как правило, не развивается. Концентрация патологического глобулина в сыворотке крови невысока, СОЭ нормальная. В костном мозге обнаруживают лимфоидные клетки и плазматические клетки разной степени зрелости. Заболевание протекает быстро и заканчивается смертью в течение нескольких месяцев. Болезнь тяжёлых цепей выявляют в основном у пожилых людей, она чаще проявляется гепатоспленомегалией. Субстрат опухоли — лимфоидные элементы разной степени зрелости. Описаны единичные случаи болезни тяжёлых цепей δ, она протекает как миеломная болезнь. Болезнь тяжёлых цепей α — наиболее частая форма, развивающаяся главным образом у детей и лиц до 30 лет, 85% случаев зарегистрировано в Средиземноморье. Иммуноэлектрофорез сыворотки крови и мочи — единственный метод диагностики заболевания, так как классический М-градиент на электрофореграмме белков сыворотки крови часто отсутствует.
Реактивные парапротеинемии возникают при наличии генетической предрасположенности в ответ на бактериальные и вирусные инфекции (гепатит, ЦМВ-инфекция) или паразитарные инвазии (лейшманиоз, токсоплазмоз, шистосомоз). Эта форма моноклональной иммуноглобулинопатии зарегистрирована при трансплантации органов, лечении цитостатиками, наследственных или приобретённых иммунодефицитах. Преходящие парапротеинемии характеризуются низкими концентрациями PIg в сыворотке крови, отсутствием или следовыми количествами белка Бенс-Джонса в моче.
Ассоциированная парапротеинемия сопровождает ряд заболеваний, в патогенезе которых играют роль иммунные механизмы: аутоиммунные заболевания, опухоли, хронические инфекции. К таким заболеваниям относятся AL-амилоидоз и криоглобулинемии.
Идиопатические парапротеинемии возникают у лиц пожилого возраста и могут представлять собой предмиеломные состояния. В таких случаях необходимо тщательное обследование для выявления начальной стадии заболевания и длительное динамическое наблюдение.
Признаки доброкачественной парапротеинемии включают: отсутствие белка Бенс-Джонса, изменений концентрации нормальных Ig, количество плазматических клеток в пунктате красного костного мозга менее 15%, лимфоцитов менее 20%, концентрация сывороточного парапротеина ниже 30 г/л.

источник
