Наиболее характерные изменения в анализах крови.У больных с начальными формами туберкулеза в крови содержится нормальное количество эритроцитов и гемоглобина. По мере нарастания патологических изменений в легочной ткани может развиться гиперхромная анемия, при резком исхудании больного могут наблюдаться явления гипохромной анемии. Может наблюдаться лейкоцитоз в пределах 12—15∙109. или количество лейкоцитов в норме. Более характерен нейтрофильный сдвиг влево.
Тяжелые формы туберкулеза протекают с эозинопенией и лимфопенией. При малых и свежих формах туберкулеза обычно наблюдается лимфоцитоз.
Повышенная СОЭ зависит от процесса туберкулеза, только при туберкулезном менингите она может быть в пределах нормы.
Обнаружение микобактерий.Имеет решающее значение не только для диагностики туберкулеза, оно чрезвычайно важно при прогнозировании течения процесса, выборе рациональной схемы лечения и правильной оценке его эффективности.
Основными методами лабораторной диагностики туберкулеза являются классические микробиологические методы: бактериоскопия; культуральное исследование, или посев; биологическая проба на чувствительных к туб. инфекции лабораторных животных.
Сбор материала на исследование. От соблюдения правил сбора, хранения и транспортировки биолог. материала зависит не только достоверность результатов, но и эпидемиологическая безопасность окружающих.
Материал для исследования собирают в стерильные контейнеры (стеклянные банки) с плотно завинчивающимися крышками. Это предотвращает попадание содержимого и загрязнение окружающей среды микобактериями и обеспечивает изоляцию исследуемого материала от широко распространенных в окружающей среде кислотоустойчивых бактерий.
Для исследования может быть использован разнообразный патологический материал: мокрота, аспират, содержимое бронхов и другие материалы, получаемые при бронхоскопии, промывные воды бронхов и желудка, экссудаты, гной, отделяемое ран, спинномозговая жидкость, кровь, моча, операционный материал, смывы с предметов и др.
У больных легочными формами объектом исследования чаще служит мокрота. Желательно, чтобы сбор мокроты производился в отдельной, хорошо вентилируемой комнате. Собирают утреннюю порцию. Если больной выделяет мало мокроты, ее следует собирать в течение суток, при этом обязательно собранный материал хранить в холодильнике. Если исследование проводится на фоне лечения, за 2 суток до сбора мокроты прием противотуберкулезных препаратов отменяется. Сбор мокроты должен производиться в присутствии и при непосредственном участии среднего мед. персонала.
Лица, ответственные за сбор мокроты, руководствуются следующими правилами:
1. Объяснить больному причины исследования и необходимость откашливать содержимое глубоких отделов дыхательных путей, а не собирать слюну или носоглоточную слизь. Необходимо предупредить больного, что он должен предварительно почистить зубы и прополоскать полость рта кипяченой водой, чтобы механически удалить основную часть микрофлоры, вегетирующей в ротовой полости.
2. Присутствующий при сборе мокроты мед. работник должен открытьь стерильный контейнер, снять с него крышку и передать больному только донную часть контейнера.
3. Стоя позади больного, следует рекомендоватьему держать контейнер как можно ближе к губам и сразу же сплевывать в него мокроту по мере ее откашливания.
4. По завершении сбора мокроты мед. работник оценивает ее количество и качество; контейнер с порцией мокроты не менее 3-5 мл, содержащей уплотненные или гнойные комочки без слюны, тщательно закрывают завинчивающейся крышкой, маркуруют и помещают в специальный ящик для транспортировки в лабораторию.
Если больной не выделяет мокроту или выделяет ее только эпизодически и в скудном количестве, то накануне и рано утром в день сбора мокроты больному следует дать отхакивающее средство или применить раздражающие аэрозольные ингаляции (усиливаются секреция бронхов, кашль и отделение мокроты). Для этого используют портативные аэрозольные ингаляторы. В качеств ингалируемой смеси можно использовать 15% р-р хлорида натрия в 1% р-ре бикарбоната натрия (150г NaCl и 10г NaHCO3 на 1 литр дистиллированной воды).
Если мокроту не удалось получить, используют промыные воды бронхов или желудка (преимущественно у детей младшего возраста, которые плохо откашливают мокроту и заглатывают ее).
Промывные воды желудка берут натощак, предварительно дав больному выпить или введя через зонд 100—150 мл раствора бикарбоната натрия (питьевой соды). Промывные воды желудка должны исследоваться немедленно, чтобы исключить повреждающее воздействие на возбудителя желудочных ферментов.
Более ценным материалом для исследования при отсутствии мокроты являются аспираты из трахеи и бронхов, бронхоальвеолярная лаважная жидкость, а также материалы прицельной биопсии, получаемые при бронхологических исследованиях.
Исследование кала на микобактерии необходимо производить при наличии признаков туберкулеза кишечника. Для исследования берут несколько комочков кала со слизью или гноем, размешивают с 5%-м изотоническим раствором хлорида натрия и фильтруют. В настоящее время туберкулез кишечника встречается исключительно редко, а поэтому исследование кала на БК практически не производится.
Для обнаружения микобактерии в плевральном экссудате, в пунктатах и отделяемом из свищей препарат приготавливают так же, как и при исследовании мокроты.
Особого методического подхода требует исследование менструальной крови. Этот материал незамедлительно доставляют в лабораторию.
Сбор мочи. Для исследования используют обычно среднюю порцию утренней мочи, полученной после тщательного туалета наружных половых органов растворами антисептиков (слабый раствор перманганата калия, риванола и пр.)
Хранение, консервация и транспортировка диагностического материала. В противотуберкулезных учреждениях функционируют специализированные лаборатории, производящие бактериологические исследования.
В стационарах стерильные контейнеры с мокротой или другим патологическим материалом доставляются непосредственно в лабораторию. Сбор материала от амбулаторных больных производится под непосредственным наблюдением среднего медицинского работника.
Если в лечебном учреждении не проводятся исследования для выявления кислотоустойчивых микобактерий, собранный диагностический материал должен централизованно доставляться в лабораторию. Обычно такая доставка осуществляется один или два раза в неделю. Следовательно, материал должен накапливаться в течение нескольких дней. Для этого используют биксы или специальные транспортировочные ящики, вмещающие 10 — 20 контейнеров, которые хранятся в холодильнике.
Во время транспортировки материал необходимо предохранять от воздействия прямых солнечных лучей и тепла. В определенных ситуациях используют консервант — 2 —3%-й раствор борной кислоты в соотношении 1:1 или глицерин. В качестве консерванта можно также использовать 10%-й раствор трехзамещенного фосфата натрия или 0,05—0,1%-й раствор хлоргексидин биглюконата в соотношении 1:1; Рост микобактерий может быть получен даже после хранения мокроты с консервантом при температуре 30 °С в течение 10—12 дней.
Бактериоскопическое исследование. Оно является одним из основных и наиболее распространенных методов. Преимущества его заключаются в простоте, дешевизне и быстроте получения результатов. Однако возможности метода ограничены. В препарате можно обнаружить единичные микобактерии, если в 1 мл материала содержится не менее 10 000— 100 000 бактериальных клеток (предел метода).
Наиболее распространенным методом окраски для выявления кислотоустойчивых микобактерий является способ Циля—Нильсена.
Мокроту на предметном стекле окрашивают карболовым фуксином, при одновременном воздействии нагревания обесцвечивают мазок в 3%-м растворе солянокислого спирта (приводит к обесцвечиванию всех некислотоустойчивых структур) и докрашивают метиленовым синим. Только микобактерии, обладающие выраженной кислото- и спиртоустоичивостью, стойко удерживают краситель и остаются окрашенными в красный цвет.
Микобактерии обнаруживаются в препарате в виде тонких, прямых или слегка изогнутых ярко-красных палочек.
В настоящее время применяется метод окраски люминисцентными красителями (более высокая информативность).
В тех случаях, когда в патологическом материале не удается обнаружить микобактерии методом бактериоскопии, производят бактериологическое исследование. Культуральный метод — посев материала на питательные среды. Преимущество метода в высокой чувствительности. Достаточно 20—100 микобактерий в 1 мл материала. Недостаток метода заключается в длительности роста колоний: 1 — 3 мес.
Применение двух методов в совокупности позволяет более точно количественно оценить степень бактериовыделения.
Исследуемый материал высевают на специальные среды после предварительной обработки. Наиболее часто используют яичные среды. Первые колонии микобактерий появляются на 18 —30-й день, а иногда и через 3 месяца.
Бактериологическое и бактериоскопическое исследование необходимо проводить в сочетании.
Биологический метод заражения животных сейчас применяется только в научно-исследовательских институтах.
В настоящее время началось использование молекулярно-биологического метода — полимеразной цепной реакции (ПЦР). Сначала выделяется ДНК микобактерии, затем она клонируется и идентифицируется. Метод очень чувствительный (достаточно 1 МБТ), однако без одновременной оценки клинической картины заболевания использовать его надо осторожно. Это — перспективный метод, но его роль еще до конца не определена.
Определение лекарственной устойчивости микобактерий.В настоящее время разработаны и внедрены в практическую деятельность диспансеров методы определения лекарственной чувствительности (устойчивости) микобактерий к туберкулостатическим препаратам. Различают первичную лекарственную устойчивость у больных, не леченных противотуберкулезными препаратами, и вторичную, развивающуяся в процессе лечения. Частота первичной устойчивости составляет 20 —80 %.
Лекарственная устойчивость микобактерий может быть: моно — к одному препарату, множественная — к смеси изониазида и рифампицина, полирезистентная — к двум и более препаратам кроме рифампицина и изониазида, перекрестная — к препаратам со сходной химической структурой.
В настоящее время внедряются генетические методы определения лекарственной устойчивости с помощью ПЦР-метода.
Не нашли то, что искали? Воспользуйтесь поиском:
источник
При подозрении на внелегочную форму заражения человека Mycobacterium tuberculosis обязательно назначается анализ мочи на туберкулез. Выявление микобактерий позволяет уточнить локализацию инфекции, на основании чего подбирается наиболее эффективная схема терапия болезни. Анализ мочи на определение бацилл Коха проводится разными методами. При возможности больному назначается каждый метод.
При заражении человека микобактериями туберкулеза чаще всего страдает дыхательная система. Но бывает очаг инфекции локализуется в костной системе, тканях головного мозга, костях и мочеполовых органах. Во время проведения диагностики важно определить очаг поражения. Поэтому помимо стандартных методов исследования, таких как флюорография, анализы крови и мокроты пациенту назначается и ряд дополнительных.
Анализ мочи на туберкулез в первую очередь необходим при подозрении на поражения бактериями мочевыделительной системы. Обязательно он должен назначаться больным:
- При продолжительном и при этом неэффективном лечении воспалительных заболеваний органов мочевыделения – пиелонефрита, цистита, пиелита, простатита, эпидидимита;
- С нарушением мочеотделения, проявляющимся задержкой мочи, появлением примесей гноя в урине, с гематурией;
- При длительных необъяснимых болях в области пояснице.
Анализ на туберкулез почек необходим и пациентам уже с установленным поражением бациллами Коха легочной ткани и других внутренних органов. Его своевременное назначение позволит вовремя обнаружить все очаги инфекции и значит, лечение будет наиболее эффективным.
Почечная локализация бактерий туберкулеза характерна для людей трудоспособного возраста. Чаще всего такая форма заболевания определяется у пациентов от 20 до 40 лет. Очень часто туберкулез почек на ранней стадии развития не проявляется явными симптомами. Поэтому нередко диагностируется уже на запущенной стадии. Исключить подобное помогает вовремя назначенный анализ мочи на микобактерии туберкулеза.
Микобактерии туберкулеза при многократном увеличении выглядят как небольшие прямые или слегка изогнутые палочки, их длина доходит только до одной сотой миллиметра. В организме человека они присутствуют там, где происходит их развитие и размножение. Поэтому при туберкулезе почек бациллы будут активно выделяться вместе с мочой. Обнаружить их в анализе можно тремя способами:
- Бактериоскопическим;
- Бактериологическим;
- Биологическим.
Врач может назначить один из перечисленных методов исследования или все сразу. В дополнение к ним обязательно нужно сдать общий анализ мочи. Так как на заболевание указывает не только присутствие бацилл Коха в пробе, но и косвенные признаки.
При проведении специфических анализов мочи на туберкулез нужно учитывать, что положительный результат всегда свидетельствует о поражении микобактериями тканей системы мочевыделения. Тогда как отрицательный результат не всегда может быть достоверным, что может быть связано с неправильным сбором урины и с другими факторами. Поэтому обычно назначается пересдача анализа и дополнительные методы диагностики.
Проведение общего анализа мочи позволяет выявить косвенные признаки болезни, такие как:
- Появление гвоздевидных лейкоцитов;
- Стойкая кислая реакция урины (практически в половине случаев заражения микобактериями);
- Появление в моче белка (протеинурия);
- Эритроцитоурия – присутствие крови в моче;
- Пиурия – гной в урине.
Если результат анализа соответствует вышеперечисленным признакам, пациента обязательно нужно отправить на дополнительное обследование, стандартное при подозрении на туберкулез.
Бактериоскопический анализ мочи иначе называется исследованием по Цилю-Нельсону. В его основе лежит устойчивость микобактерий туберкулеза по отношению к кислой среде урины. Взятый образец обрабатывается в лабораторных условиях определенными реактивами:
- Сернокислыми растворами или солянокислым спиртом. Они обесцвечивают неустойчивые к кислой среде бактерии. Тогда как кислотоустойчивые микобактерии туберкулеза оказываются окрашенными, что можно увидеть в микроскоп.
- Раствором метиленового синего хлорида. Под его воздействием палочки Коха приобретают насыщенный красно-малиновый оттенок.
Бактериоскопический посев мочи на туберкулез является наиболее быстрым. Используют его не только для обнаружения палочек Коха, но и для выявления других, устойчивых к кислым средам бактерий. Туберкулезные микобактерии при проведении анализа имеют характерный цвет и форму изогнутых или ровных палочек.
На достоверность анализа по методу окраски Циля-нельсона влияет правильный забор мочи. Поэтому все рекомендации врача по отбору пробы нужно неукоснительно соблюдать.
Бактериологическое исследование мочи является наиболее точным методом диагностики туберкулеза почек, но делается такой анализ на протяжении от 2-х до 6 недель. Вначале необходимо на протяжении трех дней подряд сдать анализ мочи, осадок урины помещается в чашку Петри с особой питательной средой, это может кровяная среда или картофельные образцы.
В питательной среде происходит рост болезнетворных микроорганизмов, после чего выявленный возбудитель идентифицируется. В кровяной среде микобактерии туберкулеза начинают расти примерно через семь дней, в картофельной для этого может потребоваться месяц и больше.
По результатам бактериологического анализа принимается решение о проведении дополнительных методов диагностики и назначается специфическое лечение.
Стопроцентно достоверный результат показывает анализ мочи при подозрении на туберкулез почек в виде биологической пробы. Ее проведение заключается во введении осадка мочи в брюшную полость или под кожу подопытному животному со склонностью к заражению болезнью. В лабораторных условиях чаще всего с этой целью используют морских свинок, крыс.
В течение месяца за условно инфицированным животным наблюдают. Если в моче пациента имелись палочки Коха то, как правило, за это время грызун погибает и подвергается исследованию с обязательным определением в организме очагов инфекции. Выявить результат биологической пробы можно и раньше, для этого у животного берут кровь на туберкулин или проводят пункцию лимфоузлов с определением наличия воспалительного процесса.
Биологическая проба назначается пациентам редко, так как не во всех лабораториях возможно ее проведение.
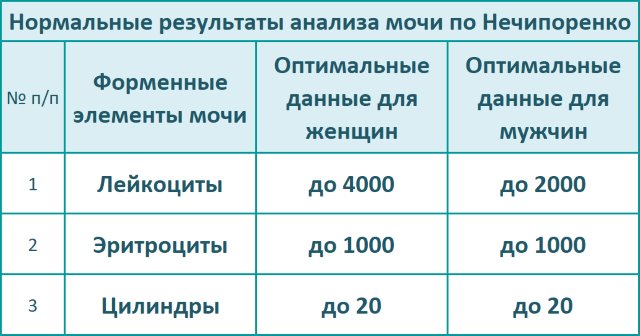
Проведение исследования мочи по Нечипоренко по сравнению с общим анализом является более достоверным. Данное исследование дает полную картину о содержании эритроцитов и лейкоцитов в образце урины, определяет количество белковых клеток. Отклонение от нормы не всегда свидетельствует об инфицировании туберкулезом, но точно указывает на инфекционно-воспалительный процесс в мочевыделительной системе. Чтобы определить причину выявленных изменений и установить заболевание пациенту назначаются другие лабораторные методы исследования и инструментальная диагностика.
Моча при туберкулезе покажет присутствие палочек Коха только в том случае, если проба будет взята правильно. Обязательно требуется подготовка, она заключается:
- В отказе от употребления за 1-2 дня до забора биологической жидкости продуктов, окрашивающих урину. Это свекла, морковка, черника;
- В исключении использования ряда медикаментов для лечения сопутствующих болезней – диуретиков, жаропонижающих средств, витаминов группы В.
Если лечение ранее диагностированной болезни не предполагает перерыв в приеме медикаментов, нужно сообщить об этом врачу. Также нельзя накануне пить спиртные напитки, желательно воздержаться и от курения. Для выявления микобактерий необходим чистый образец урины, поэтому женщины в период менструаций сдавать анализ не должны.
Чтобы точно установить заболевание с поражением почек необходима утренняя порция мочи. Собирают ее, следя нескольким правилам:
- Заранее нужно подготовить емкость с крышкой — специальные баночки для проб продаются в аптеках;
- Область половых органов тщательно подмыть и лучше делать это без мыла;
- Собрать среднюю порцию мочи. То есть мочеиспускание начать в унитаз, затем струю направить в баночку и затем вновь в унитаз. Для исследования достаточно 50 мл урины;
- Емкость сразу закрыть завинчивающейся крышкой и поставить в прохладное место.
В большинстве случаев образец мочи на микобактерии туберкулеза собирается дома. Но его необходимо как можно раньше увести в лабораторию. В «свежей» урине палочки Коха определяются легче и поэтому результат таких анализов редко бывает ложноотрицательным.
Туберкулез – заболевание, трудно поддающееся диагностики на ранней стадии. В России повсеместно распространена проба Манту, ее начинают проводить с раннего возраста. Но она не всегда дает точные результаты, поэтому необходимы и другие анализы. На начальном этапе диагностики назначают флюорографию и анализ крови. Если при их проведении возникает подозрение на туберкулез, пациента отправляют на расширенное обследование, в него входит:
- Рентгенография;
- Туберкулиновые пробы;
- МРТ;
- Анализ крови по методу ПЦР и ИФА;
- Анализ мокроты.
Практически со стопроцентной точностью болезнь устанавливает анализ ПЦР, но он дорогой и проводится не во всех лабораториях.
Флюорография, исследование мокроты являются достоверными, если очаг поражения локализуется в бронхолегочной системе. При внелегочных формах заболевания их результаты не точны, поэтому диагноз выставляется только после расширенного обследования, включающего и проведения анализа мочи.
Диагностические исследования, направленные на выявление туберкулеза, повсеместно распространены. Но к сожалению в большинстве государственных учреждений используются только устаревшие методы, которые не всегда определяют микобактерии при их присутствии в организме. Чтобы получить точные результаты можно обратиться в современные медцентры. Анализы в них в зависимости от их вида проводятся как платно, так и бесплатно.
Если вам известно что-либо новое об исследовании на туберкулез, напишите пожалуйста в комментариях, это может пригодиться многим людям. Желательно поделиться статьей и в соцсетях, так как не все знают, что существуют другие способы обследования, помимо стандартной флюорографии.
источник

Для обнаружения возбудителя туберкулеза в биологическом материале больных применяют следующие методы: микроскопию препаратов патологического материала по методу Циля-Нельсена; люминесцентную микроскопию патологического материала; полимеразно-цепную реакцию; бактериологический (культуральный) метод.
Микроскопия препаратов патологического материала по методу Циля- Нельсена является основным методом выявления кислотоустойчивых микобактерий (КУМ).
На основании микроскопического исследования можно сделать заключение только о наличии или отсутствии в препарате КУМ. Это объясняется тем, что в природе существует большое разнообразие видов микобактерий, включая и нетуберкулезные, одинаково хорошо воспринимающих окраску раствором карболового фуксина.
Мазки патологического материала обрабатывают карболовым фуксином, а затем обесцвечивают 5% раствором серной кислоты или 3% раствором солянокислого спирта. Докрашивают мазки 0,25% раствором метиленового синего.
Окрашенные препараты просматривают в световом микроскопе с иммерсионной системой. КУМ окрашиваются в красный, а окружающий фон — в синий.
При микроскопическом исследовании препарата, окрашенного по методу Циля-Нельсена, следует просматривать не менее 100 полей зрения, что обычно вполне достаточно, чтобы обнаружить в препарате единичные КУМ. В том случае, если результат исследования оказывается отрицательным, для подтверждения необходимо просмотреть дополнительно 200 полей зрения.
Результат исследования возможно получить в течение 1 ч, но обычно его выдают через 24 ч. Значимыми преимуществами бактериоскопического выявления КУМ в патологическом материале больных туберкулезом является доступность метода, его экономичность и быстрота получения результата. Вместе с тем метод относительно малочувствителен (необходимо, чтобы в 1 мл исследуемого материала содержалось не менее 50—100 тыс. микробных тел) и недостаточно специфичен.
Люминесцентная микроскопия увеличивает разрешающую способность микроскопии по сравнению с окраской по Цилю-Нельсену на 14—30%. Для окраски используют флюорохромы — органические красители, флюоресцирующие при освещении ультрафиолетовыми, фиолетовыми или синими лучами. Такими красителями являются аурамин 00 и родамин С.
Препарат исследуют с помощью люминесцентного микроскопа: микобактерии светятся золотисто-желтым цветом на темном фоне. Количество КУМ, обнаруживаемых при микроскопическом исследовании, является очень важным информационным показателем, так как характеризует степень эпидемической опасности больного и тяжесть заболевания.
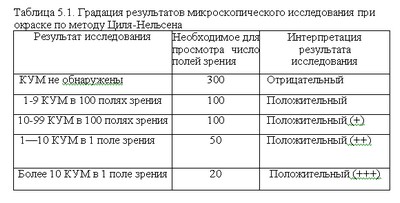
Поэтому микроскопическое исследование должно быть не только качественным, но обязательно и количественным. При использовании объектива 90х-100х и окуляра микроскопии мазка мокроты 7х— 10х(общее увеличение — 630х— ЮООх) принята следующая градация результатов световой иммерсионной микроскопии по методу Циля-Нельсена, представленная в таблице:
Полимеразно-цепная реакция (ПЦР) является одним из наиболее быстрых и информативных методов выявления МБТ. Принцип метода состоит в увеличении в 106—108 раз числа копий специфического участка ДНК МБТ, катализируемого in vitroRH К-полимеразой в автоматическом режиме.
В искусственных условиях воспроизведение процесса репликации специфического или определенного вида или рода возбудителей участка генома возможно при условии знания его нуклеотидной последовательности. Применение методов детекции продуктов репликации таких участков (ампликоны) позволяет констатировать наличие возбудителя в исследуемой пробе.
К достоинствам метода ПЦР относятся:
- высокая чувствительность, позволяющая определять 10—100 клеток в биологической пробе;
- высокая специфичность ДНК МБТ в исследуемом материале;
- универсальность процедуры обнаружения МБТ из одной биологических проб;
- высокая скорость анализа (4—4,5 ч).
Вместе с тем высокая разрешающая способность метода в ряде случаев может приводить к ложноположительным результатам, что ограничивает достоверность исследования.
Бактериологический (культуральный) метод выявления МБТ заключается в посеве мокроты и другого патологического материала на питательные среды. Для эффективного выделения культуры МБТ достаточно единичных жизнеспособных бактериальных клеток (20-100 микробных тел) в образце диагностического материала. Рост культуры регистрируют за 21-90 сут.
Для посева диагностического материала используют разнообразные питательные среды, среди которых можно выделить три основные группы: плотные питательные среды на яичной основе; плотные или полужидкие питательные среды на агаровой основе; жидкие синтетические и полусинтетические питательные среды. В России наиболее широкое распространение получила плотная питательная среда Левенштейна-Йенсена.
Среду Левенштейна-Йенсена применяют во всем мире в качестве стандартной среды для первичного выделения возбудителя туберкулеза и определения его лекарственной чувствительности. Рост МБТ на этой среде проявляется в диапазоне от трех недель до трех месяцев (в среднем 1,5 мес).
Вирулентные культуры МБТ обычно растут на плотных питательных средах в виде R-колоний (от англ. rough — грубый, шершавый) различной величины и вида, имеют желтоватый или слегка кремовый оттенок (цвет слоновой кости), шероховатую поверхность, напоминающую манную крупу или цветную капусту.
Интенсивность роста МБТ определяют по трехбалльной системе: «+» 1 — 20 колоний (скудное бактериовыделение); «++» 21—100 колоний (умеренное бактериовыделение); «+++» более 100 колоний (обильное бактериовыделение).
Лекарственную устойчивость МБТ определяют методом абсолютных концентраций на плотной яичной питательной среде Левенштейна— Йенсена, основанной на добавлении определенных стандартных концентраций противотуберкулезных препаратов, которые принято называть критическими при расчете на мкг/мл.
Культура МБТ считается чувствительной к той или иной концентрации противотуберкулезного препарата, которая содержится в среде, если число колоний МБТ, выросших на одной пробирке с препаратом, не превышает 20, а посевная доза соответствует 107 микробных тел.
Уровень устойчивости данного штамма МБТ в целом выражается той максимальной концентрацией препарата (количество мкг в 1 мл питательной среды), при которой еще наблюдается размножение МБТ. Для различных противотуберкулезных препаратов установлена определенная критическая концентрация. Она имеет клиническое значение, так как отражает воздействие препарата на МБТ в условиях макроорганизма.
Для метода абсолютных концентраций появление более 20 колоний на питательной среде, содержащей противотуберкулезный препарат, в критической концентрации свидетельствует о том, что данный штамм МБТ обладает лекарственной устойчивостью.
Критические концентрации противотуберкулезных препаратов при определении лекарственной устойчивости методом абсолютных концентраций на среде Левенштейна-Йенсена составляют для:
- изониазида 1 мкг/мл;
- рифампицина — 40 мкг/мл;
- пиразинамида — 200 мкг/мл;
- этамбутола — 2 мкг/мл;
- стрептомицина — 10 мкг/мл;
- канамицина — 30 мкг/мл;
- капреомицина — 30 мкг/мл;
- протионамида (этионамида) — 30 мкг/мл;
- циклосерина — 30 мкг/мл;
- ПАСК — 1 мкг/мл;
- офлоксацина — 2 мкг/мл.
В большинстве случаев метод абсолютных концентраций применяется для непрямого определения лекарственной устойчивости. Вначале производят посевы мокроты на твердые питательные среды и получают чистую культуру МБТ, которую пересевают на питательные среды, содержащие определенные концентрации противотуберкулезных препаратов.
Так как сроки выделения МБТ на питательных средах составляют
не менее 1,5 мес, то результаты определения устойчивости указанным методом обычно получают не ранее чем через 2—2,5 мес после посева материала.
Кроме описанных выше классических методов культивирования МБТ и определения лекарственной устойчивости, в России нашли свое применение следующие современные системы.
Система ВАСТЕС460 — радиометрический метод быстрого определения роста МБТ путем регистрации уровня меченного С02, образующегося в процессе утилизации субстрата с пальмитиновой кислотой, содержащей радиоактивный С14. Для роста МБТ в данной системе используют флаконы с жидкой питательной средой, которая представляет собой обогащенную среду Middlebrook 7H9, содержащую радиоактивный С14. При размножении МБТ утилизируют С14 и выделяют С1402; в этом случае учет идет по нарастанию С1402.
Система ВАСТЕС MGIT960 — индикаторные пробирки MGIT (М. Growth Indicator Tube) с той же средой Middlebrook 7Н9; содержат в придонной части флюоресцирующий индикатор (трис-4,7-дифкнил-1, Юфенантролин рутениум хлорид пентагидрат), «погашенный» высокими концентрациями 02. В процессе роста МБТ поглощают 02, что сопровождается усилением свечения индикатора, интенсивность которого оценивают при помощи трансиллюминатора.
Полностью автоматизированный комплекс позволяет одновременно исследовать лекарственную чувствительность МБТ в 960 исследуемых образцах.
Наличие роста МБТ в системе ВАСТЕС регистрируется на 4—5-й день от момента посева. В системе ВАСТЕС, где используют те же абсолютные концентрации противотуберкулезных препаратов, учет лекарственной устойчивости идет в течение 6 нед.
В последние годы для быстрого определения лекарственной устойчивости используют метод микрочипов, основанный на молекулярно-генетическом анализе (ПЦР) выявления точечных мутаций в гроВ гене, ответственном за устойчивость к рифампицину, и в katG гене, ответственном за лекарственную устойчивость к изониазиду.
Установлено, что более 95% устойчивых к рифампицину штаммов МБТ содержат точечные мутации (делеции и вставки в гроВ гене, кодирующих Р-субъединицу РНК-полимеразы), и что более 70% устойчивых к изониазиду штаммов МБТ имеют делеции и вставки в katG гене, кодирующих каталазу/пероксидазу. Результаты метода микрочипов могут быть получены на 3-4-й день исследования.
источник
Туберкулез — общее инфекционное заболевание с преимущественной локализацией процесса в легких. При туберкулезе также поражаются лимфатические узлы, серозные оболочки, пищеварительный тракт, урогенитальная система, кожа, кости и суставы (туберкулез внелегочной локализации).
Материал для исследования: мокрота, слизь с задней стенки глотки, промывные воды бронхов и желудка, моча, спинномозговая жидкость, плевральный экссудат, гной из абсцессов и др.
Больной собирает мокроту в чистую баночку или карманную плевательницу. Лучшие результаты дают исследования мокроты, выделенной больным в течение полусуток. На баночку наклеивают бумажку с фамилией и инициалами больного, заполняют специальный сопроводительный бланк (фамилия и инициалы больного, диагноз, группа диспансерного учета, цель исследования) и направляют в лабораторию.
В микробиологической диагностике туберкулеза используют бактериоскопический, бактериологический и биологический методы, а также комплекс иммунологических исследований.
Бактериоскопический метод
Туберкулезные микобактерииокрашиваются в красный цвет, все остальные элементы мокроты и другие бактерии — в синий. Туберкулезные микобактерии имеют вид тонких, слегка изогнутых палочек различной длины с утолщениями на концах или посередине, располагаются группами и поодиночке.
При окраске по Цилю—Нильсену в красный цвет окрашиваются также кислотоустойчивые сапрофиты. Они находятся в почве, воде, молоке, масле, сметане, коже здоровых людей, желудке и т.д. При окраске по Цилю—Нильсену их трудно отличить от МБТ. Кислотоустойчивые сапрофитные бактерии окрашиваются в вишневокрасный цвет, но теряют свою окраску при длительном обесцвечивании солянокислым спиртовым раствором (от 3 ч до суток) или 0,01% раствором гипохлорита калия (КС10). Кислотоустойчивые сапрофиты в отличие от МБТ толстые, грубые, короткие, незернистые, иногда со вздутиями на концах, заостренные или веретенообразные, располагаются чаще кучками. Необходимо помнить, что аэробный микроорганизм Нокардиа (Nocardia asteroides), имеющий нежные, палочковидные, разветвляющиеся волокна диаметром 1 мкм, попадает в легкие при вдыхании воздуха и также затрудняет бактериоскопическую диагностику.
Кислотоустойчивая сапрофитная флора отличается от МБТ культуральными и биохимическими свойствами.
Положительное заключение выдают при обнаружении микобактерии туберкулеза в препарате после просмотра не менее 100 полей зрения: обязательно указывают число микробов в поле зрения. Отрицательный результат микроскопии необязательно должен свидетельствовать об отсутствии микобактерии в исследуемом материале.
Метод люминесцентной микроскопии
Препараты мокроты и промывных вод бронхов можно исследовать люминисцентным методом.
Принцип. Туберкулезные микобактерии, окрашенные ауромином-родамином, люминесцируют под влиянием ультрафиолетовых лучей в виде светящихся золотистых палочек (метод менее трудоемкий и более быстрый, чем предыдущие).
Мазки-препараты приготовляют из осадка, полученного методом накопления, фиксируют проведением через пламя. Мазки окрашивают в течение 15 мин смесью растворов флюорохромных красителей: на 1000 мл дистиллированной воды 1,0 ауромина 00 и 0,1 родамина С. После окраски мазок обесцвечивают 3% раствором соляно-кислого спирта в течение 30 сек, промывают водой. Если фон мазка сильно флюоресцирует, следует применить в качестве гасителя 0,25% водный раствор метиленового синего, промыть мазок водой, подсушить и микроскопировать в люминесцентном микроскопе. Микобактерии светятся золотисто-желтым светом на темно-зеленом фоне. Положительный ответ выдается, если в препарате обнаружено не меньше 4—5 палочек. При наличии 1—2 палочек в препарате анализ следует повторить.
Окраска ауромином-родамином, кроме того, выявляет нежизнеспособные МБТ. При окраске по Цилю—Нильсену они не выявляются, поэтому для оценки прогноза все аурамин-родамин позитивные пробы должны быть окрашены также и по Цилю—Нильсену.
Окрашивание ауромином-родамином имеет следующие преимущества перед окраской по Цилю—Нильсену:
1. кислотоустойчивые бациллы имеют большее сродство к ауромин-родаминовой окраске;
2. весь мазок может быть просмотрен при небольшом увеличении;
3. на темном фоне во флюоресцентном микроскопе МБТ выделяются более четко, и это позволяет быстрее и точнее просмотреть весь мазок.
При люминесценции кислотоустойчивые сапрофиты имеют бледно-желтый или зелено-желтый оттенок свечения, отличающийся от золотисто-оранжевого свечения МБТ.Исследуемую мокроту переносят в чашку Петри, с помощью препаровальных игл или пинцета выбирают гнойные комочки и переносят их на середину предметного стекла, накрывают комочек другим предметным стеклом и растирают материал между стеклами. Спинномозговую жидкость отстаивают в холодильнике и готовят мазки из нежной пленки фибрина. Мочу центрифугируют и делают мазки из осадка. Препараты обесцвечивают не только кислотой, но и спиртом для дифференциации от M.smegmatis, которые могут находиться в моче здоровых лиц.
Гомогенизация. Собрать в банку суточное количество мокроты и добавить равный объем 1% NaOH, закрыть стерильной резиновой пробкой и встряхивать в шюттель-аппарате до полного разжижения мокроты. Обычно для этого требуется 10-15 мин. Гомогенизированную мокроту переносят в центрифужные пробирки и центрифугируют при 3000 оборотов в минуту в течение 10-15 мин. Жидкость сливают в раствор хлорамина, осадок нейтрализуют 1-2 каплями 10% раствора НСl, из осадка приготовляют мазки, окрашивают по Цилю-Нильсену и микроскопируют.
Флотация. Мокроту переливают в колбу, прибавляют равный объем 1% раствора NaOH, закрывают резиновой пробкой и встряхивают в шюттель-аппарате до полного разжижения. Колбу помещают в водяную баню 55°С и нагревают в течение 30 мин. а затем добавляют 1-2 капли ксилола или бензина, встряхивают 10 мин, доливают дистиллированную воду до горлышка колбы и оставляют при комнатной температуре на 25-30 мин.
Углеводород всплывает на поверхность и увлекает адсорбированные микобактерии. Образуется тонкий слой углеводорода и возбудителей туберкулеза в горлышке колбы в виде сливкообразного кольца.
На хорошо нагретую водяную баню кладут обычное стекло 20х20 см и на нем раскладывают предметные стекла для мазков. Проволочной петлей в форме улитки берут материал флотационного кольца и наносят на предметные стекла, по мере подсыхания материала добавляют новую порцию взвеси. Наслоение материала по принципу толстой капли на одно и то же место делают 3-4 раза, каждую каплю подсушивают, прежде чем наносят следующую.
Готовые, хорошо высушенные препараты промывают эфиром (огнеопасно!), подсушивают, фиксируют, окрашивают и бактериоскопируют.
Исследование промывных вод бронхов или желудка выполняют после нейтрализации материала 1-2 мл 0.5% раствора NaOH.
Флотация повышает на 10% обнаружение микобактерии туберкулеза в патологическом материале.
Бактериоскопическим методом удается обнаружить возбудителя туберкулеза при содержании в 1 мл патологического материала более тысячи микобактерии.
Бактериологический метод
Все материалы для исследования бактериологическим методом, как правило, содержат постоянную микрофлору, что практически делает невозможным выделить микобактерии в чистой культуре без предварительной обработки материалов. Исключением из этого правила является стерильно взятая спинномозговая жидкость.
С целью уничтожения сопутствующей микрофлоры и гомогенизации мокроты, гноя и других материалов применяют 10% раствор серной кислоты или 10% раствор трехзамещенного фосфорнокислого натрия 1:1.
Жидкие материалы центрифугируют 30-40 мин, осадок обрабатывают серной кислотой в течение 20-30 мин, устанавливают рН среды в пределах 7,2-7,6 и высевают на среду Левенштейна — Йенсена и среду Финн-2. Засеянные среды инкубируют в термостате при температуре 37°С 3-4 недели. Пробирки со средами, в которые исследуемый материал вносили петлей и втирали в поверхность среды, размещают вертикально; в тех случаях, когда посевы делают пастеровской пипеткой, пробирки помещают в термостат в полугоризоптальном положении на 2-3 сут, а затем вертикально. Все пробки заливают расплавленным парафином или закрывают целлофановым колпачком и уплотняют резиновым кольцом.
Посевы просматривают раз в неделю. Все пробирки, в которых обнаружен рост посторонней микробной флоры, удаляют. Рост микобактерий туберкулеза обычно обнаруживается на 3-й неделе, но иногда через 2,5-3 мес.
Микобактерии туберкулеза формируют колонии на плотных питательных средах с характерными признаками. Они как правило, сухие, морщинистые, грубые (напоминают бородавки), обычно в R-форме. S-форма колоний с пигментацией желтого или оранжевого цвета при влажном росте свойственна другим микобактериям.
При учете результатов следует фиксировать обильность и сроки появления роста микобактерий. Эти показатели, определяемые в динамике, имеют эпидемиологическое и прогностическое значение.
Культуры микобактерий туберкулеза, выращенные на питательных средах, микроскопируют. В мазках, окрашенных по Цилю — Нильсену, образуются скопления кислотоустойчивых типичных микобактерий.
В молодых культурах, выделенных из организма больных, леченных антибактериальными препаратами, обнаруживают микроорганизмы с измененной формой (короткие палочки, неправильной формы шары).
В некоторых случаях исследуемый материал высевают на 3-4 пробирки жидкой питательной среды с плазмой крови донора или сывороткой крупного рогатого скота.
Результаты посева учитывают через 10 дней. Берут одну пробирку и стерилизуют, из осадка готовят мазки, фиксируют, окрашивают и микроскопируют. Отрицательный результат выдают только после инкубирования посевов в термостате в течение месяца. Посторонние микроорганизмы в таких питательных средах растут, размножаются в первые дни культивирования и вызывают помутнение жидкости.
Микобактерии, выращенные на жидкой питательной среде, пересевают в пробирки с плотной средой. В таких случаях положительные результаты возрастают, но продолжительность исследования увеличивается.
Микобактерии могут размножаться и образовывать микроколонии на стекле. Для этой цели готовят полоски обычного стекла 10 см длиной и 0,9-1 см шириной, моют, обезжиривают, сушат и стерилизуют.
Мокроту больного выливают в чашку Петри, выбирают гнойные комочки, наносят их на полоску стекла и растирают другой такой же полоской так, чтобы получились два мазка, занимающие 2/3 длины стекла. Стекла кладут на стерильную бумагу и подсушивают. Сухие мазки погружают на 15-20 мин в пробирки с 2% раствором серной кислоты, а затем 2-3 раза промывают дистиллированной водой и помещают в жидкую синтетическую или кровяную среду, в которую добавляют 10 ЕД/мл пенициллина. Мазок должен быть полностью покрыт питательной средой. Инкубируют в термостате при 37-38°С. Результаты учитываются на 1-й. 15-й и 30-й день. Каждый раз один такой мазок вынимают из пробирки, высушивают, фиксируют, окрашивают по Цилю — Нильсену или аурамином и микроскопируют. Положительными будут посевы, в которых на стекле выявляются микроскопические колонии в виде «жгутиков», «кос» и «пауков».
Определение лекарственной устойчивости
микобактерий туберкулеза
Лекарственную устойчивость микобактерий туберкулеза определяют с помощью бактериологических методов перед началом лечения, затем спустя 3 мес и далее при продолжающемся выделении бактерий туберкулеза через каждые б мес. Это делают путем выращивания микобактерий на питательных средах с различным содержанием препарата, к которому определяют устойчивость, и на тех же средах без добавления его (контроль).
Определение лекарственной устойчивости может быть: а) прямое — посев соответственно обработанного патологического материала (мокрота, гной и т.д.) на среды, содержащие лекарственные препараты; б) непрямое — пересев предварительно выделенных чистых культур микобактерий туберкулеза на среды, содержащие лекарственные препараты.
Прямой способ более эффективен, но им можно пользоваться, если микобактерии обнаруживаются в материале бактериоскопически и содержатся в значительном количестве (1-5 палочек в поле зрения). Наиболее распространенными методами определения лекарственной устойчивости являются:
1) культивирование на плотных яичных средах;
2) микрокультивирование на стеклах;
3) глубинные посевы на полусинтетические среды;.
Результаты исследования учитывают по истечении определенного срока выращивания, достаточного для получения обильного роста в контрольных пробирках.
В остальных пробирках в зависимости от концентрации препарата и степени устойчивости к нему данного штамма микобактерии туберкулеза рост может быть различной интенсивности или к этому времени отсутствовать.
Лекарственно чувствительные штаммы дают рост в пределах определенных концентраций, различных для каждого препарата.
Штаммы, которые дают рост при соответственно более высоком содержании препаратов, относят к лекарственно устойчивым. Устойчивость определяют по макроросту на плотных и по микроросту на жидких средах. Устойчивость данного штамма в целом выражается той максимальной концентрацией антибактериального препарата (количество микрограммов в 1 мл питательной среды), при которой еще наблюдается рост, приближающийся к росту в контроле.
В части случаев выявляется обильный типичный рост микобактерии в присутствии той или другой концентрации антибактериального препарата, а на среде, содержащей более высокие концентрации этого же препарата, рост может быть скудным в виде единичных макро- или микроколоний, что указывает на размножение только некоторых, более резистентных, особей данного штамма. В таких случаях отмечают как максимальную концентрацию препарата, при которой еще размножается основная устойчивая масса микробных особей, так и предельную — при скудном росте («относительная устойчивость» см. таб.).
Дата добавления: 2016-12-17 ; просмотров: 870 | Нарушение авторских прав
источник
Анализ мочи – один из способов выявления микобактерий туберкулеза в организме человека. Он применяется наряду с туберкулиновыми пробами, аппаратными методами диагностики, анализами крови и мокроты.
Исследование используется для выявления внелегочных форм заболевания: туберкулеза почек, мочевыводящих путей, половой системы.
Как проводится анализ мочи для выявления возбудителей заболевания, какие правила нужно соблюдать, чтобы получить точный результат?
Туберкулез почек и мочеполовой системы встречается реже, чем легочная форма заболевания, но из-за отсутствия выраженных симптомов и осложненной диагностики часто вызывает серьезные последствия.
Фото 1. Изображение почек, видоизмененных туберкулезной инфекцией.
Основное показание к проведению анализа мочи — подозрение на внелегочную форму туберкулеза. Данное исследование назначается людям, которые на протяжении долгого времени безуспешно лечатся от таких патологий, как цистит, воспаление предстательной железы и придатков, почек, мочекаменная болезнь. Отсутствие результатов лечения мочеполовых заболеваний может говорить о том, что их причиной являются микобактерии туберкулеза.
При подтвержденном диагнозе это исследование проводится для того, чтобы определить вид микобактерий и подобрать правильную схему лечения, а в запущенных случаях — для оценки состояния мочевыводящей системы.
Справка. При легочной форме заболевания общий анализ мочи практически неинформативен, так как патологический процесс не вызывает ярких изменений в ее составе.
При поражении организма туберкулезом микобактерии выделяются со всеми биологическими жидкостями, в том числе и с мочой. Наиболее точные методы диагностики заболевания — бактериоскопия или посев образца биоматериала на питательные среды. Для выявления микроорганизмов используется утренняя порция мочи, причем исследование рекомендуется повторить 2-3 раза, так как определить заражение с помощью первой порции мочи удается далеко не всегда.
Важно! Внелегочные формы туберкулеза зачастую протекают бессимптомно (иногда больные ощущают небольшой дискомфорт в области поясницы), поэтому анализ мочи играет важную роль в своевременной диагностике и терапии заболевания.
Для получения достоверного результата пациенту рекомендуется следовать нескольким правилам:
- за сутки не употреблять продукты, которые могут изменить цвет жидкости (свекла, черника, морковь и т.д.);
- отказаться от приема некоторых медикаментов: диуретиков, витаминов группы В, аспирина;
- женщинам сбор материала лучше осуществлять до или после менструального кровотечения.
Перед сбором мочи рекомендуется тщательно помыть половые органы, после чего собрать «среднюю» мочу в стерильную емкость. Чтобы избежать загрязнения и попадания бактерий в биоматериал, емкость необходимо сразу же плотно закрыть. Перед сдачей образца в лабораторию его следует хранить в прохладном месте.
Внимание! Загрязнение биоматериала может привести к угнетению роста микобактерий и получению ложноотрицательного результата.
Микобактерии туберкулеза относятся к низшим грибам и представляют собой палочки длиной не более одной сотой миллиметра. В анализе мочи их можно выявить тремя способами: бактериоскопическим, бактериологическим, с помощью биологической пробы.
Бактериоскопический (по Цилю-Нильсену). Суть метода заключается в том, что микобактерии не способны жить в кислотной среде, поэтому для их выявления используются специальные реактивы, которые окрашивают все неустойчивые структуры. Сначала их обесцвечивают с помощью серной кислоты, после чего вводят раствор метиленового синего. Благодаря этому все структуры и клетки приобретают ярко-синий цвет, за исключением микобактерии, которая становится малиново-красной.
Минус данного способа заключается в том, что мочу достаточно сложно очистить от посторонних примесей, из-за чего точность исследования снижается (для повышения диагностической ценности исследования мочу берут с помощью катетера).
Бактериологический. Еще один способ выявления возбудителей туберкулеза в анализе мочи — бактериологический. Для выполнения берется осадок мочи, после чего его культивируют на питательной среде.
Минус метода — достаточно долгое ожидание результата. Точные сроки варьируются в зависимости от вида среды, которая применяется для культивации биоматериала. При использовании кровяной среды результат придется ждать около 7 дней, картофельной — 30-45 дней.
Фото 2. Результат бактериологического теста: в чашке Петри выращены бактерии, которые находились в осадке мочи пациента.
Биологическая проба. Наиболее чувствительный метод выявления микобактерий, который часто используется вместо реакции Манту.
Для проведения исследования морской свинке вводят образец мочи, через несколько месяцев животное можно использовать для точной диагностики. Чтобы поставить диагноз раньше, можно взять у свинки туберкулиновую пробу.
Точность бактериоскопического и бактериологического анализа составляет около 80%, точность биологической пробы — 100%.
Для выявления туберкулеза мочеполовой системы используется не только бактериологический, но и общий анализ мочи. Показателями заболевания являются не только микобактерии, но и характерные гвоздевидные лейкоциты, белок (протеинурия), неспецифические бактерии, повышение концентрации эритроцитов. Кислая реакция образца биоматериала наблюдается примерно в 60% случаев, поэтому не может считаться точным критерием диагностики.
Справка. Наиболее информативным показателем туберкулеза, по мнению большинства специалистов, является классическая триада: пиурия (наличие гноя в образце), альбуминурия (или следы белка), а также кислая реакция.
источник
Одним из эффективных методов диагностики является анализ мочи на туберкулез. Для выявления болезни предложено несколько современных методик исследования, которые позволяют обнаружить специфические признаки заболевания. Своевременная диагностика туберкулеза очень важна, так как на ранних стадиях устранить заболевание значительно легче, чем при длительном течении.
Исследование на туберкулез почек необходимо для выявления признаков Mycobacterium tuberculosis (палочки Коха) в моче. Этот микроорганизм является возбудителем заболевания. При активном туберкулезе микобактерии присутствуют в биологических жидкостях больного (крови, мокроте, моче). Их обнаружение позволяет установить диагноз и своевременно начать лечение.
Анализ мочи на туберкулез назначается, если у пациента имеются заболевания выделительной и половой системы, которые не купируются привычным лечением. К таким патологиям относятся:
Длительно протекающие, хронические формы болезни, плохо поддающиеся лечению, — это повод заподозрить микобактериальную этиологию воспалительного процесса (туберкулез почек). Важно понимать, что возбудители не обязательно повреждают только легкие. Возможно развитие атипичных форм, в том числе и с поражением мочевыделительной системы. С током крови возбудители могут распространяться из других органов и поражать почки. Для выявления таких форм заболевания необходим анализ мочи на туберкулез.
Чтобы получить достоверный результат исследования, необходимо тщательно подготовиться к забору анализа. За несколько дней до процедуры необходимо:
1. Тщательно соблюдать правила личной гигиены;
2. По возможности отказаться от использования лекарственных средств, влияющих на работу почек (стимуляторов мочеотделения, противовоспалительных средств, антибиотиков);
3. Контролировать водный режим – пить достаточно воды (в среднем 2 литра в сутки), однако не допускать избыточного потребления жидкости, так как это может спровоцировать изменении в анализах;
4. Не есть продукты, которые могут окрасить мочу в непривычный цвет (морковь, ягоды, свеклу).
Женщинам не рекомендуется проводить анализ в период месячных, так как обнаружение менструальной крови в моче может быть расценено как признак патологии почек.
Непосредственно перед сбором материала, в утреннее время, нужно тщательно вымыть наружные половые органы. Это необходимо для того, чтобы в анализ не попала та флора, которая находится на коже пациента. При обработке не рекомендуется использовать сильные антисептические средства, так как их остатки останутся на коже даже после тщательного промывания. Воздействие антисептика может уничтожить некоторые бактерии, что смажет результат исследования.
Моча при туберкулезе собирается в утреннее время. Желательно использовать специальные аптечные контейнеры, которые точно не содержат сторонней микрофлоры. Приспособленные для анализов баночки невозможно достаточно эффективно обработать в домашних условиях, поэтому при использовании таких емкостей всегда присутствует риск получить ложноположительный результат.
После сбора мочи на микобактерии туберкулеза необходимо срочно доставить его в лабораторию. До этого анализ необходимо держать в прохладном месте для того, чтобы в образце не размножались бактерии.
Для проведения анализа мочи на микобактерии используются три методики диагностики заболевания:
- Бактериоскопический методика;
- Бактериологический методика;
- Биологическая методика.
Каждый из способов диагностики болезни имеет свои преимущества и недостатки. В большинстве случаев используется комбинация нескольких методов для точного подтверждения диагноза туберкулеза.
Бактериоскопический анализ мочи на палочки Коха предполагает исследование образца под микроскопом с целью обнаружения микобактерий. На предметное стекло помещается биологический материал, после чего на него наносится несколько реактивов, которые окрашивают микобактерии в определенный цвет, что позволяет возбудителя болезни отличить их от другой микрофлоры.
Наиболее часто проводится окраска микропрепарата по Цилю-Нильсену, так как такая методика хорошо визуализирует именно палочки Коха — возбудителей туберкулеза. Она предполагает последнее использование серной кислоты и метиленовой сини. После окраски цитоплазма бактерии будет иметь малиновый цвет. Остальная флора окрашивается в малиновый или красный. Микобактерии необходимо особо тщательно отличать от палочек смегмы. Эти микробы иногда высеваются в моче здорового человека. Они не являются патогенными бактериями, их наличие не приводит к развитию воспалительного процесса. Если лаборант примет палочки смегмы за микобактерии туберкулеза, то получится недостоверный ложноположительный результат исследования.
К преимуществам использования бактериоскопического метода диагностики болезни относятся:
- Простота исследования (не требует использования специализированного оборудования и питательных сред);
- Дешевизна методики;
- Возможность быстро получить результат.
Недостатком бактериоскопической диагностики является недостаточная информативность. Микобактерии туберкулеза в моче могут присутствовать в небольших количествах, которые не обнаружатся при исследовании. Кроме того, в анализе мочи присутствует много лишних примесей, которые затрудняют микроскопическое исследование. Из-за посторонних объектов в поле зрения можно получить неправильный результат анализа.
Для повышения информативности исследования используется методика флотации. Для этого моча отстаивается в течение 24 часов, после чего она разделяется на две порции. Верхний слой сливается, а нижний слой, содержащий осадок и бактерии, обрабатывается с помощью специальных аппаратов. Такая обработка способствует «сгущению» патологических примесей, отделению осадка от жидкости. В полученном концентрате количество бактерий на единицу объема выше, чем в исходном образце, поэтому обнаружить возбудителей туберкулеза мочеполовой системы значительно проще.
Из-за своих недостатков бактериоскопия считается предварительным скрининговым методом, позволяющим провести начальное обследование пациента. Результат исследования затем будет дополнен более информативными способами обнаружения заболевания.
Отсутствие микобактерий при микроскопии не является подтверждением того, что у пациента нет туберкулеза.
В этом случае необходимо провести бактериологический анализ, который является золотым стандартом диагностики заболевания.
Бактериологическая методика предполагает культивирование бактерии биологического материала на питательной среде. Моча сеется на кровяную или картофельную среду и помещается в специальный аппарат – термостат. Там образец культивируется несколько суток, после чего лаборант оценивает рост микроорганизмов в нем. Если на среде есть колонии, характерные для бактерии туберкулеза, то из них берется образец и повторно пересевается на другую чистую среду. Манипуляция необходима для получения чистой колонии без побочных микроорганизмов других видов.
Образец повторно культивируется в термостате. Выросшие колонии оцениваются по следующим критериям:
• Морфологические критерии (внешний вид палочки Коха под микроскопом);
• Культуральные свойства (характерный цвет колоний, оценка форм, размеров и т.д.);
• Биохимические свойства (реакция микроорганизма на те или иные питательные вещества);
• Серологические свойства (взаимодействие с образцами антител, специфичных к возбудителю туберкулеза).
На основании перечисленных показателей определяется вид микроорганизма, который является возбудителем болезни.
Бактериологический анализ имеет ряд важных преимуществ:
• Высокая информативность методики;
• Отсутствие побочных микроорганизмов в итоговом образце;
• Меньшая вероятность ошибки при исследовании.
Дополнительным плюсом способа является возможность проведения теста на чувствительность к антибиотикам. Для этого на высеянные колонии помещаются образцы нескольких антибактериальных средств. Те препараты, к которым чувствителен микроорганизм, будут сдерживать рост колоний. Методика очень важна в практической медицине, так как она позволяет назначить пациенту лечение заболевания мочеполовой системы, которое будет эффективным.
Недостатком использования бактериологической диагностики является длительный срок проведения исследования.
Во время диагностики необходимо дважды культивировать микроорганизмы в термостате, поэтому результат диагностики можно получить как минимум через 3-4 дня. В большинстве случаев срок ожидания увеличивается до недели.
Таким образом, бактериоскопия и бактериологическое исследование хорошо дополняют друг друга. Бактериоскопическая диагностика позволяет быстро исследовать состав микрофлоры мочи, она используется для срочного обследования пациента. На этом этапе пациенту назначаются антибиотики широкого спектра, которые воздействуют не только на микобактерии, но и на других возможных возбудителей.
Посев мочи при туберкулезе проводится дольше, но обладает большей информативностью. Его результат подтверждает или опровергает бактериоскопические данные. На основании теста антибиотикочувствительности корректируется используемое лечение, при необходимости назначаются более узкоспециализированные средства, активно уничтожающие микобактерии туберкулеза.
Биологическая диагностика – это дополнительный метод исследования, который используется в тяжелых диагностических случаях. Если с помощью бактериологического исследования выявить возбудителя не удается, то проводится заражение лабораторного животного биологическим материалом пациента. Наибольшей чувствительностью к микобактериям туберкулеза обладают морские свинки, реже используются крысы или мыши.
Через некоторое время после заражения животное вскрывают, из его крови и тканей готовят препараты и исследуют их на содержание возбудителей туберкулеза. Чтобы получить результат на ранних этапах, можно использовать проба Манту или Диаскинтест.
Биологическая методика является наиболее точным исследованием. Вероятность выявления микобактерий при его проведении составляет 100%. Недостатком исследования является длительный срок культивации и сложность методики (необходимость использования лабораторных животных). Биологическая диагностика применяется при длительном течении заболевания и отсутствии эффекта от лечения.
Таким образом, исследование мочи позволяет обнаружить туберкулез почек и других органов мочеполовой системы. Обнаружение микобактерий позволяет подтвердить наличие заболевания и своевременно назначить лечение.
Туберкулез – это опасная патология, о которой должен знать каждый. Проходили ли вы исследование мочи на туберкулез? Оставляйте свое мнение о анализе и делитесь личным опытом в комментариях.
источник