
У здорового человека моча в почках и мочевом пузыре стерильна, но появление бактерий не обязательно свидетельствует о наличии инфекционного заболевания. Например, при мочеиспускании в мочу попадают непатогенные микробы из нестерильного нижнего отдела уретры. Другие причины появления бактерий без наличия ИМП обусловлены длительным стоянием мочи до проведения анализа (размножение бактерий) и несоблюдением гигиенических условий сбора мочи (поступление бактерий с наружных половых органов).
По существу, ББУ представляет собой микробиологический диагноз, который основывается на исследовании мочи, собранной с максимальным соблюдением стерильности и доставленной в лабораторию в предельно короткие сроки, что позволяет в наибольшей степени ограничить рост бактерий (см. правила сбора мочи для лабораторного исследования).
Распространенность ББУ варьирует в широких пределах в разных популяциях и зависит от пола и возраста, половой активности, функциональных и структурных нарушений, сопутствующей патологии. В раннем детстве ББУ встречается крайне редко (0,001% у мальчиков в возрасте до 5 лет и у 1 — 4% девочек) и развивается, как правило, на фоне врожденных аномалий развития мочевыводящей системы. Для молодых здоровых мужчин ББУ не характерна, однако у пожилых ее частота нарастает с 3,6 до 19%, что обусловлено развитием гиперплазии предстательной железы и нарушением уродинамики. Среди здорового женского населения распространенность ББУ также увеличивается с возрастом — от 1% среди школьниц до 16% и более среди женщин 70 лет и старше. У молодых здоровых женщин (пременопаузальных замужних) ББУ тесно связана с сексуальной активностью и составляет примерно 5%. При беременности частота ББУ составляет 2 — 9% и более. ББУ также характерна для пациентов с повреждениями спинного мозга с нарушениями функций тазовых органов или мочевыми катетерами (кратковременная установка катетера — частота ББУ составляет 9 — 23%; при долговременных катетерах ББУ выявляется в 100% [! все пациенты с постоянным катетером имеют бактериурию]). Факторам риска развития ББУ является сахарный диабет.
В структуре возбудителей ББУ у женщин наиболее часто выделяется Escherichia coli (80 — 85%), при этом высеваемые штаммы характеризуются меньшей вирулентностью, чем штаммы Escherichia coli, выделенные при острой инфекции мочевых путей. У беременных чаще высевается Escherichia coli – 65 — 70%, реже — Klebsiella pneumonia (до 10%). В качестве возможных причин рецидивов инфекции мочевых путей при беременности предполагают инфицирование Proteus mirabilis и Enterococcus faecalis. Для мужчин при ББУ наиболее характерно выделение Proteus mirabilis, а также коагулазонегативных стафилококков, грамотрицательных микроорганизмов и Enterococcus spp. При наличии постоянного катетера вне зависимости от пола обычно отмечается полимикробная бактериурия, и наиболее часто в этих случаях высеваются Pseudomonas aeruginosa и уреазопродуцирующие микроорганизмы (Proteus mirabilis, Providencia stuartii, Morganella morganii).
Как правило, ББУ вызвана одним штаммом уропатогена, присутствие в моче двух и более видов микроорганизмов, особенно Lactobacilli, Corynebacteria species, Gardnerella, свидетельствует о контаминации мочи флорой с аногенитальной области
Для выявления бактерий в моче существуют ориентировочные методы (химические тесты, микроскопия) и бактериологические тесты (посев мочи на стерильность). Бактериурия при микроскопии мочи выявляется, если в поле зрения микроскопа при увеличении 400 обнаруживают 1 и более бактерий, что предполагает рост колоний в культуре, превышающий 10*5 бактерий в 1 мл мочи. Золотым стандартом в диагностике инфекций мочевых путей считают посев мочи, который проводят с целью идентификации возбудителя и определения его чувствительности к антибиотикам. Также в клинической практике для диагностики бактериурии (и лейкоцитурии) широко используются несложные и недорогие экспресс-тесты в виде погружаемых в пробу мочи специально подготовленных бумажных полосок, в течение нескольких минут изменяющих свой цвет в присутствии тестируемого агента. Экспресс-тест на бактериурию основан на определении в моче нитритов, которые синтезируются микроорганизмами из нитратов (экспресс-тест на лейкоцитурию базируется на определении в моче эстераз гранулоцитов).
Согласно критериям Американского общества инфекционных болезней ( > у женщин при выделении одного и того же штамма бактерий в титре 10*5 КОЕ/мл не менее чем в двух образцах средней порции мочи, последовательно собранных в асептических условиях с промежутком более 24 часов;
у мужчин при однократном выделении бактериального штамма в анализе мочи в количестве 10*5 КОЕ/мл;
у лиц при однократном выделении бактериального штамма в количестве 10*2 в образце мочи, полученном при катетеризации мочевого пузыря;
у пациентов с постоянным уретральным катетером концентрация уропатогенов 10*5 КОЕ/мл при посеве мочи;
у пациентов при выделении бактериального штамма в титре 10*5 КОЕ/мл при посеве мочи, полученной при катетеризации в асептических условиях.
Следует отметить: если в двух последовательно собранных пробах мочи выявляются разные микроорганизмы, диагноз бактериурии не может считаться установленным даже при получении значимых титров микроорганизмов. Обычно подобные результаты связаны с погрешностью сбора (контаминацией) пробы или с лабораторной ошибкой. Подчеркнем также, что бессимптомная бактериурия может иметь место при нормальном анализе мочи и, наоборот, отсутствовать при выраженной лейкоцитурии. В этой связи общий анализ средней порции мочи не должен интерпретироваться в контексте диагностики бактериурии — данный диагноз устанавливается только на основании соответствующим образом выполненных посевов мочи.
Проведение скрининга на выявление ББУ оправдано только у беременных (оптимальный срок беременности для скрининга – 12 — 16 недель) ввиду угрозы тяжелых осложнений у матери (сепсис, ДВС-синдром, шок, респираторный дистресс-синдром, смерть) и плода (низкий вес новорожденных), у пациентов перед проведением инвазивных вмешательств (операция и/или инструментальное исследование) на органах мочеполовой системы (в т.ч. имеющих высокий риск развития кровотечения при повреждении слизистой), диализным пациентам с ББУ перед операцией трансплантации почки и с целью профилактики септических осложнений на фоне последующей иммуносупрессивной терапии. В остальных случаях скрининг на выявление ББУ не проводится.
Эмпирическая антимикробная терапия у пациентов с ББУ не проводится. Как правило, лечение назначают тем пациентам, у которых скрининг на выявление ББУ является обязательным (см. выше). Лечение ББУ обязательно у беременных женщин, поскольку риск развития восходящей острой ИМП составляет 20 — 40%. Для лечения ББУ предпочтительно использовать в качестве препаратов 1-й линии фторированные хинолоны, а 2-й линии – нитрофураны. Данные препараты не создают в других тканях терапевтических концентраций, поэтому их применение сопровождается меньшими риском селекции резистентных штаммов микроорганизмов в популяции и нарушениями биоценоза макроорганизма. В качестве препаратов 2-й линии также можно использовать цефалоспорины (цефалексин, цефуроксим и цефиксим). Продолжительность курса антибактериальной терапии ББ составляет от 1 дня (фосфомицин) до 3 — 7 дней – в зависимости от клинической ситуации. При рецидивах повторно проводят лечение в течение 7 — 10 дней. При ББУ, возникшей после катетеризации мочевого пузыря, назначают однократный прием антибиотика.
источник
Протейная инфекция (proteus)
Протейные инфекции вызываются протеями и составляют большую группу заболеваний под общим названием протеозы.
Протей долго считали сапрофитом, распространенным в окружающей среде, но в настоящее время сформировалось положение о протеях как условно-патогенных микроорганизмах, возбудителях нозокомиальных инфекций.
Бактерии рода Proteus распространены повсеместно. Их выделяют из почвы, воды и атмосферного воздуха. В стационарах протеи можно обнаружить на предметах ухода за больными, медицинской аппаратуре, санитарно-гигиеническом оборудовании. Столь широкое распространение этих бактерий и формирование госпитальных штаммов объясняют широким применением антибиотиков и высокой резистентностью протея к большинству из них. В отделениях для новорожденных протеи могут вызвать экзогенную нозокомиальную инфекцию. В целом среди возбудителей госпитальных инфекций на долю протеев приходится около 10%.
Источником инфекции является больной или бактериовыделитель. Наибольшую опасность представляют больные с кишечной протейной инфекцией, так как при этом возбудитель выделяется с испражнениями в огромных количествах (до 10 7 -10 8 бактерий в 1 г фекалий). Однако и при гнойно-воспалительных процессах (нагноение операционных ран, ожоговых поверхностей, остеомиелит, отит, флегмоны и др.), а также при заболеваниях мочевых путей протейной этиологии происходит значительное выделение протея во внешнюю среду.
Восприимчивы к протейной инфекции новорожденные и дети раннего возраста, лица с аномалиями и поражением мочевых путей, а также ослабленные различными заболеваниями и хирургическими вмешательствами. Инфекция передается контактным и пищевым путем через инфицированные продукты (мясо, рыба, творог, фруктово-овощные смеси), а также предметы ухода, медицинскую аппаратуру, инструменты. Заболевания протеозами регистрируются в течение всего года, преобладает спорадическая заболеваемость.
Выделяют 5 видов представителей рода Proteus: P. vulgaris, P. mirabilis, P. morganii, P. retgeri и P. inconstans (providencia). Бактерии каждого вида различаются по антигенной структуре, на основе которой разработана диагностическая схема, включающая определение числа О-групп и сероваров. P. mirabilis и P. vulgaris занимают ведущее положение среди протеев всех видов. Они хорошо растут на питательных средах Плоскирева, Вильсона-Блера и слабощелочном агаре с добавлением 0,3-0,4% раствора карболовой кислоты.
Входными воротами при протеозах являются желудочнокишечный тракт, мочевые пути, раневые и ожоговые поверхности. В месте внедрения протеи подавляют сопутствующую флору и выделяют ряд токсически действующих факторов (бактериоцины и лейкоцидин), угнетающих барьерные функции клеточных систем макроорганизма; формируется устойчивость микроорганизмов к бактерицидной активности сыворотки крови. Колонизация мочевых путей облегчается выработкой протеями уреазы — фермента, расщепляющего мочевину, что приводит к ощелачиванию мочи, нарушению целостности эпителия мочевых путей и снижению его резистентности.
В тонкой кишке протеи вызывают развитие энтерита, энтероколита в зависимости от дозы и вирулентности штамма возбудителя и состояния макроорганизма. В ближайшие часы после инфицирования часть бактерий проникает в стенку кишки и гематогенным, а возможно и лимфогенным путем заносится в органы, где возбудитель сохраняется и, вероятно, размножается в течение нескольких дней. При наличии условий возникают вторичные очаги, которые при снижении резистентности организма могут обусловить локальные инфекционные процессы или вторичную бактериемию. Таким образом, при экзогенном заражении протеи способны не только вызвать кишечную инфекцию, но и сделать кишечник источником потенциальной эндогенной инфекции различной локализации.
Гнойно-воспалительные процессы на коже, в костной ткани, поражения мочевых путей, желудочно-кишечного тракта, мозговых оболочек, уха, придаточных пазух, легких и др. У детей в основном поражается желудочно-кишечный тракт. На втором месте по частоте находится инфекция мочевой системы.
При кишечной инфекции заражение происходит в результате контакта с больными диареей или при употреблении инфицированной протеем пищи. Инкубационный период колеблется от нескольких часов до 2 сут. Заболевание развивается остро, начинается с общеинфекционных симптомов и нарушения функции желудочно-кишечного тракта. В 1-й день болезни температура тела повышается до 37,5-38,5 °С и сохраняется 5-7 дней и дольше. Аппетит ухудшается (у некоторых больных — вплоть до анорексии). Наиболее часто возникают гастроэнтерит и энтерит, реже — гастроэнтероколит и энтероколит. Повторная рвота (3-5 раз в сутки) бывает первые 2-3 дня. Стул водянистый, желто-зеленого цвета, зловонный, с непереваренными комочками пищи, с непостоянной примесью слизи, от 5 до 10 раз в сутки. У каждого 3-го больного выражен метеоризм и отмечаются боли в животе. У половины больных увеличена печень и у трети — селезенка.
У детей 1-го года жизни развивается кишечный токсикоз с эксикозом I-II степени. Это проявляется потерей массы тела, сухостью кожи и слизистых оболочек, уменьшением эластичности кожных покровов и снижением тургора мягких тканей. Нарушения сердечно-сосудистой системы проявляются приглушением тонов сердца, относительной тахикардией, иногда — систолическим шумом. Патологические изменения легких могут проявляться токсической одышкой или развитием пневмонии. В разгар заболевания наблюдается олигурия с умеренным количеством белка в моче. В периферической крови у половины больных регистрируются лейкоцитоз, нейтрофилез, палочкоядерный сдвиг, СОЭ умеренно повышена.
Продолжительность кишечной инфекции — от 5 до 10 дней; дольше всех симптомов сохраняется дисфункция кишечника с вторичными нарушениями пищеварения (дисахаридазная недостаточность и др.). Морфологические изменения в кишечнике можно определить как острый серозный энтерит. Гистологически выявляют полнокровие, отек стенок кишок и поверхностные дефекты. В слизистой оболочке и подслизистом слое кишки обнаруживаются лимфогистиоцитарные инфильтраты. В остальных внутренних органах наблюдаются дистрофические процессы; может развиться пневмония. При затяжном энтероколите нередко возникают глубокие множественные язвы диаметром 0,2-0,5 см с приподнятыми краями, в отдельных случаях они располагаются в области единичных лимфатических фолликулов.
Поражение мочевых путей обычно наблюдается у детей с аномалией развития почек и органов мочевой системы. Частое поражение мочевых путей объясняется выработкой протеями фермента уреазы, способствующей нарушению целостности эпителия мочевых путей и внедрению возбудителя в эти ткани. Попав в мочевую систему, протеи закрепляются в паренхиме почек, вызывая развитие пиелонефрита.
Клинически протейные пиелонефриты проявляются тупыми болями в поясничной области, субфебрильной температурой тела и повышенной утомляемостью; возможна транзиторная гипертензия. В моче умеренное количество лейкоцитов, небольшое число эритроцитов и 2-3-кратное повышение уровня белка. Изменения мочевого осадка сопровождаются упорной бактериурией, достигающей 10 5 микробных тел и более в 1 мл. Рентгенологически выявляются уменьшение тени почек, «изъеденность» паренхимы чашечек, изменение их конфигурации.
Особенности заболеваний у новорожденных и детей 1-го года жизни
Вспышки протейной инфекции в отделениях для новорожденных нередки. Инфицирование происходит во влажных кювезах или через аппаратуру. Протейная инфекция у новорожденных может иметь разнообразную локализацию. Протейная диарея начинается бурно, с подъема температуры тела до 37,5-38 °С, рвоты и жидкого стула с зеленью и слизью. Отмечаются вздутие живота, болезненность, урчание по ходу кишечника. В течение первых 2-3 сут на фоне общеинфекционного токсикоза развивается дегидратация. Дети отказываются от груди, становятся вялыми, у них появляется токсическая одышка.
Возможна инфекция пупочной ранки — омфалит в сочетании с инфекцией пупочных сосудов в виде септического артериита и флебита, захватывающего пупочную и портальную вены.
Протейная инфекция у новорожденных может развиваться в виде острого гнойного менингита с септицемией. Заболевание начинается внезапно, с подъема температуры тела до 38 °С, беспокойства, нарушения ритма дыхания, появления цианоза. У детей резко ослабевает сосательный рефлекс, возникают спастические судороги в конечностях, гемипарезы; дети пронзительно кричат. В крови отмечается лейкоцитоз более 10 9 , в спинномозговой жидкости — плеоцитоз с преобладанием нейтрофилов (до 70-90%). Если ребенок выживает, то наблюдаются отставание в психомоторном развитии и судорожные припадки.
Проводят бактериологическое исследование испражнений, рвотных масс, мочи, крови, отделяемого из воспалительных очагов на коже. Кроме того, на присутствие бактерий исследуют пищевые продукты, воду, смывы с окружающих больного предметов, медицинской аппаратуры, лекарственные растворы. При повторном обнаружении у больного с кишечной дисфункцией более 105 колониеобразующих протейных клеток в 1 г испражнений можно диагностировать протейную инфекцию; 105 и более протейных бактериальных клеток в 1 мл мочи также свидетельствует о протейной этиологии патологического процесса в мочевых путях. Большое диагностическое значение придается данным серологических исследований. Антитела к аутоштамму протея начинают выявляться в РА с 5- 6-го дня болезни в титрах 1:200 и 1:400 с максимумом к 9-15-му дню от начала заболевания (1:400-1:1600). Применяют также РСК и РПГА.
Заболевания мочевых путей с протейной бактериурией сопровождаются появлением антипротейных антител в титрах от 1:160 до 1:640. При пиелонефритах и септических состояниях диагностическое значение придается титрам антипротейных антител 1:320 и выше.
Принципы терапии при кишечной инфекции протейной этиологии те же, что и при других бактериальных кишечных инфекциях. При легких формах назначают колипротейный бактериофаг. При тяжелых формах дают антибактериальные препараты (гентамицин, защищенные пенициллины, цефалоспорины III поколения). Для нормализации микрофлоры кишечника в периоде реконвалесценции рекомендуют бактерийные препараты.
Для больных с поражением мочевыводящих путей и почечной паренхимы важно восстановление нормального пассажа мочи. Показанием к назначению антибактериальной терапии в этих случаях служат бактериурия (более 10 5 микробных тел в 1 мл мочи) и признаки пиелонефрита. Уроштаммы протея устойчивы к пенициллину, эритромицину, полимиксину и сохраняют высокую чувствительность к препаратам налидиксовой кислоты. Для усиления эффективности противопротейных препаратов целесообразно их сочетание. В лечении больных с тяжелыми формами протейной инфекции применяют колипротейную плазму и антипротейную иммунную сыворотку.
Исход тяжелых генерализованных форм протейной инфекции у новорожденных недоношенных детей может оказаться неблагоприятным. Острые кишечные инфекции протейной этиологии заканчиваются, как правило, выздоровлением. Протейная инфекция мочевой системы бывает упорной, с рецидивами; в последние годы часто формируется вялотекущий пиелонефрит, трудно поддающийся лечению.
Специфической профилактики протеозов не разработано. Важное значение для предупреждения кишечной инфекции имеет соблюдение санитарно-гигиенических правил. Большие трудности представляет борьба с нозокомиальной протейной инфекцией, особенно в палатах для новорожденных и в урологических стационарах. Для снижения риска инфицирования протеем в указанных медицинских учреждениях необходимо наряду с применением дезинфекции и антисептических средств ограничивать до минимума инвазивные манипуляции.
Инфекция, вызванная бактерией Морганелла морганьи (Morganella Morganii)
Морганелла морганьи является грамотрицательной бактерией. Морганелла морганьи представитель нормальной флоры внутри кишечного тракта человека, млекопитающих и рептилий.
Хотя Морганелла morganii имеет широкое распространение, однако она является редкой причиной внебольничной инфекции и чаще всего встречается в послеоперационном периоде и при внутрибольничных инфекциях, вызывая инфекции мочевыводящих путей и др.
Морганелла была впервые описана британским бактериологом Х. де Р. Морган в 1906 году. Морган выделил бактерии из кала младенцев. Позже, в 1919 году, Уинслоу и др. назвали её бацилла Моргана, Bacillus morganii.
Морганелла morganii является оксидаз-отрицательным факультативным анаэробом. Этот организм движется с помощью перитрихиальных жгутиков, но некоторые штаммы не образуют жгутиков при температуре 30 °C.
Морганелла морганьи может производить фермент каталазу, поэтому способна преобразовать перекись водорода на воду и кислород. Это обычный фермент, который присутствует в большинстве живых организмов.
Морганелла morganii может служить причиной инфекций мочевыводящих путей, нозокомиальной хирургической раневой инфекции, перитонита, инфекции центральной нервной системы, эндофтальмита, воспаления легких, хориоамнионита, сепсиса новорожденных, некротический фасциита и артрита. Многочисленные случаи внутрибольничной инфекции были описаны, как правило, в качестве послеоперационных раневых инфекций или инфекций мочевыводящих путей. Пациенты, у которых развивалась бактериемия, как правило, были с ослабленным иммунитетом, сахарным диабетом, или имели хотя бы одно серьезное основное заболевание.
Лечение инфекций Морганелла morganii могут включать:
— цефалоспорины третьего поколения и четвертого поколения.
Некоторые штаммы М. morganii, устойчивы к пенициллину, ампициллину/сульбактаму, оксациллину, первому и второму поколению цефалоспоринов, макролидам, линкозамидам, фосфомицину, колистину и полимиксину В.
1. Pulaski, E. J.; Deitz, G. W. (1940). «Morgan’s bacillus septicemia». Journal of the American Medical Association. 115 (11): 922.
2. Chen, Yu-Tin; Peng, Hwei-Ling; Shia, Wei-Chung; Hsu, Fang-Rong; Ken, Chuian-Fu; Tsao, Yu-Ming; Chen, Chang-Hua; Liu, Chun-Eng; Hsieh, Ming-Feng; Chen, Huang-Chi; Tang, Chuan-Yi; Ku, Tien-Hsiung (2012). «Whole-genome sequencing and identification of Morganella morganii KT pathogenicity-related genes» (PDF). BMC Genomics. 13 (Suppl 7): S4.
3. O’Hara CM, Brenner FW, Miller JM (13 October 2000). «Classification, identification, and clinical significance of Proteus, Providencia, and Morganella.». Clinical Microbiology Reviews. 4. 13 (4)
4. Herrara, Jose. «Morganella morganii». Truman State University Biology. Truman State University. Retrieved December 2012.
5. «Morganella morganii». University of Windsor. Retrieved 6 December 2012.
6. Cunha MD, Burke. «Proteae Infections». Merck Manual. Retrieved 8 December 2012.
7. Инфекционные болезни у детей: учебник. Учайкин В.Ф., Нисевич Н.И., Шамшева О.В. 2013. — 688 с.: ил.
источник
Морганелла могании Это грамотрицательная комменсальная палочка кишечного тракта человека, других млекопитающих и рептилий. Хотя эта бактерия широко распространена у разных видов, она редко вызывает заболевание у здоровых людей, однако является патогенным микроорганизмом..
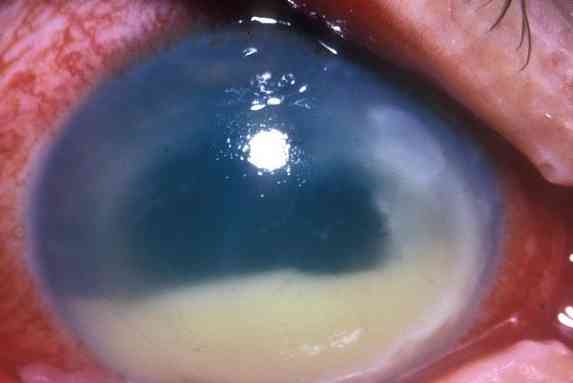
Он может вызывать тяжелые инфекции, включая эндофтальмит (инфекция, поражающая земной шар), инфекции центральной нервной системы, стенокардию Людвига (инфекцию полости рта), бактериемию и инфекцию мочевыводящих путей..
Морганелла могании может развить устойчивость к антибиотикам, и хотя тяжелые инфекции с этой бактерией встречаются редко, они имеют высокую смертность без адекватного лечения.
Его выявление должно проводиться с помощью лабораторного анализа, поскольку симптомы заболеваний, которые он вызывает, можно спутать с симптомами других заболеваний или с симптомами других возбудителей..
- 1 Характеристики
- 2 Таксономическая и систематическая история
- 3 Жизненный цикл Морганеллы Моргании
- 4 Заболевания, которые могут вызвать
- 4.1 Диарея
- 4.2 Инфекции мочевыводящих путей
- 4.3 Сепсис и бактериемия
- 4.4 Другие болезни
- 5 Симптомы инфекции
- 5.1 Диарея
- 5.2 Инфекции мочевыводящих путей
- 5.3 Сепсис и бактериемия
- 6 процедур
- 6.1 Диарея
- 6.2 Инфекции мочевыводящих путей
- 6.3 Сепсис и бактериемия
- 7 ссылок
Морганелла могании представляет собой грамотрицательную бактерию, факультативную анаэробную и отрицательную оксидазу, с прямой формой стержня от 0,6 до 0,7 мкм в диаметре и от 1,0 до 1,8 мкм в длину.
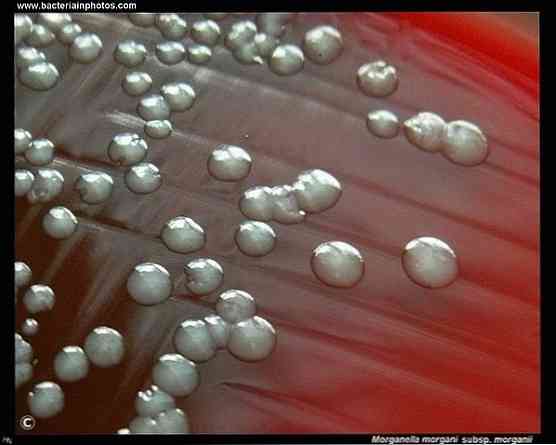
Его колонии кажутся белесыми и непрозрачными при выращивании на чашках с агаром. Он жгутикуется при температуре ниже 30 ° C, однако при температуре выше этого он не может образовывать жгутик. Не образует рои.
Пол Morganella, принадлежащий племени Proteeae, семейства Enterobacteriaceae, был возведен Фултоном в 1943 году для содержания только в одном «двух видах», описанных ранее, Bacillus columbensis и Протей Моргании.
В этой работе Фултон продемонстрировал, что эти два вида действительно были одним и тем же видом, принимая специфический эпитет Протей Моргании, для того, чтобы быть первым, чтобы быть описанным.
действительно, Протей Моргании впервые был описан в 1906 г. британским бактериологом Х. де Р. Морганом, который выделил описанный материал из кала детей, страдающих «летней диареей».
Морган назвал бактерии «бацилла Моргана». Эта бацилла была позже переименована в Bacillus morganii Уинслоу и соавторы в 1919 году и как Протей Моргании Раусс в 1936 году.
На сегодняшний день жанр Morganella Он представлен двумя видами: Морганелла Моргания с двумя подвидами (Морганелла Моргании Моргании и Морганелла Моргании Сибонии) и Морганелла Психротолеранс.
Морганелла могании Его можно получить как в почве, так и в незагрязненных и сточных водах. Этот организм быстро колонизирует кишечный тракт многих видов в первые часы его жизни, где он живет как посетитель, не оказывая воздействия на здоровые организмы..
Однако бацилла может неконтролируемо развиваться и приобретать высокую патогенность, если она случайно проникает (открытые раны, удаление зубов, хирургические операции) в части тела, где ее обычно не обнаруживают, или если у хозяина ослаблен иммунитет..
Хотя Морганелла Моргания Он часто встречается в фекалиях здоровых организмов, его частота заметно выше в случаях диареи. Однако это также может быть вызвано другими патогенами, такими как вирусы, другие бактерии, такие как Кишечная палочка, некоторые продукты и лекарства.
Морганелла Моргания был вовлечен в случаях инфекций мочевыводящих путей у людей, однако его участие в этом типе заболеваний ниже, чем у Proteus mirabilis, из-за его более низкой скорости роста в моче и неиндуцируемой природы ее уреазы.
Среди бактерий племени Proteeae, виды, принадлежащие к роду Протей они являются наиболее распространенными патогенами человека и вызывают различные внутрибольничные заболевания, включая инфекции мочевыводящих путей, сепсис и раневые инфекции.
Бактериемия из-за Морганелла Моргания, со своей стороны, они все еще относительно редки. Тем не менее, последние связаны с высокими показателями смертности, особенно в тех случаях, которые не получают адекватную терапию антибиотиками.
Морганелла Моргания был указан как возбудитель пневмонии, эндофтальмита, эмпиемы (скопление гноя в полости тела), инфекций хирургических ран, сепсиса новорожденных, спонтанного бактериального перитонита, инфекций центральной нервной системы и стенокардии Людвига, среди других заболеваний.
Этот вид также был выделен от змей и кур, страдающих респираторными заболеваниями, травмами глаз от пятнистых тюленей и морских слонов, септицемией у аллигаторов и пневмонией у ягуаров и морских свинок..
Не ясно, если во всех этих случаях Морганелла Моргания был возбудителем болезней или оппортунистическим колонизатором ранее пораженных тканей.
Симптомы диареи, вызванной Морганелла Моргани Они аналогичны тем, которые вызываются другими агентами, и включают испражнение в жидком стуле три или более раз в день, спазмы в животе и тошноту. Они также могут включать кровь в стуле, лихорадку, озноб и рвоту.
Инфекции мочевыводящих путей могут протекать бессимптомно или проявляться, среди прочего, следующими симптомами: частая и скудная, облачная, красная, розовая или коричневая моча и сильный запах, острая и постоянная потребность в мочеиспускании, ощущение жжения при мочеиспускании, тазовая боль у женщин.
Бактериемия — это присутствие бактерий в кровотоке в результате инфекции, раны или медицинской процедуры. Это может быть бессимптомно или вызвать небольшую лихорадку, но это может быть осложнено при сепсисе.
Сепсис является опасным для жизни осложнением инфекции. Среди его симптомов: очень высокая температура тела (более 38,3 ° C) или низкая (менее 36 ° C), более 90 ударов сердца в минуту, более 20 вдохов в минуту.
При осложнении могут возникнуть озноб, сенсорные нарушения, гипотензия, боль в животе, тошнота, рвота или диарея..
Предлагаемое лечение является общим для лечения диареи:
- Принимайте большое количество жидкости и регидратационных солей, чтобы избежать обезвоживания.
- Избегайте потребления молока.
- Не принимайте безрецептурные противодиарейные препараты.
- Отдых и отдых.
Для инфекций мочевыводящих путей, вызванных Морганелла Моргания, Лечение следует проводить с помощью пероральных хинолонов, таких как ципрофлоксацин. Также можно использовать цефалоспорины третьего поколения и триметоприм-сульфаметоксазол или карбапенемы..
Не существует 100% эффективного лечения, потому что бактерии могут развить устойчивость к лекарствам. Цефалоспорины третьего или четвертого поколения с аминогликозидами или без них были предложены для лечения инфекций Morganella и уменьшить возможное появление устойчивости к лечению.
Карбапенемические средства также использовались с добавлением других противомикробных препаратов или аминогликозидов в случаях бактериемии..
Для пациентов с аллергией на эти препараты рекомендуется использовать хинолоны, такие как ципрофлоксацин или высокие дозы триметоприм-сульфаметоксазола и аминогликозидов..
источник
Род Proteus семейства Enterobacteriaceae включает грамотрицательные бактерии, не ферментирующие лактозу и характеризующиеся активной подвижностью и ползучим распространяющимся ростом на поверхности плотных питательных сред. Микроорганизмы, которые ранее были классифицированы и отнесены к роду Proteus, после недавно проведенного детального изучения ДНК получили новые названия. Р. morganii был классифицирован как Morganella morganii, тогда как некоторые биогруппы В. rettgeri были реклассифицированы как Providencia stuartii и Providencia rettgeri. P. mirabilis и Р. vulgaris сохранили свою номенклатуру. Р. mirabilis вызывает 75—90% инфекций человека и отличается от других упомянутых микроорганизмов тем, что не обладает способностью образовывать индол. Все четыре вида расщепляют мочевину с образованием аммония. Некоторые штаммы Р. vulgaris имеют общий антиген с определенными риккетсиями, за счет которого объясняется появление антител к протеям (реакция Вейля — Феликса) при тифе, японской речной лихорадке (цуцугамуши) и лихорадке Скалистых гор. Микроорганизмы, объединяемые в группу Providencia, очень тесно примыкают к представителям рода протеев, отличаясь от них только некоторыми биохимическими свойствами.
Эти микроорганизмы в норме обнаруживаются в почве, воде и сточных водах и входят в состав нормальной флоры кишечника. Иногда им приписывают этиологическую роль при диареях детей раннего возраста, но это не получило достаточных подтверждений. Их часто обнаруживают в посеве из отделяемого поверхностных ран, дренированных полостей среднего уха и из мокроты, особенно у больных, получавших антибиотики. В подобных условиях они замещают более чувствительную флору, погибающую под действием этих препаратов.
Указанные микроорганизмы редко служат причиной первичного поражения. Обычно они вызывают заболевание в участках, ранее инфицированных другими возбудителями: на коже, в ушах, сосцевидном отростке, синусах, глазах, брюшной полости, костях, мочевом тракте, мозговых оболочках, легких, кровяном русле.
Кожные инфекции. Эти микроорганизмы присутствуют в отделяемом хирургических ран, особенно после антимикробной терапии, но никогда не присоединяются к нормальной раневой микрофлоре, если происходит нормальное заживление, ткани жизнеспособны и нет инородных тел. Часто в ассоциации с другими грамотрицательными бактериями или стафилакокками они могут инфицировать ожоговые поверхности, варикозные раны, язвы, образующиеся при пролежнях.
Инфекции уха и сосцевидного синуса. Воспаление среднего уха и мастоидит, особенно вызванные Р. mirabilis, могут привести к обширной деструкции среднего уха и сосцевидного синуса. Зловонные выделения, холестеатома и грануляционная ткань составляют хронический фокус инфекции в среднем и внутреннем ухе и в сосцевидном отростке, в результате чего развивается глухота. В качестве случайного осложнения возможно развитие паралича лицевого нерва. Основная опасность этих инфекций заключается в возможности их распространения в полость черепа, что ведет к тромбозу бокового синуса, менингиту, абсцессу мозга и бактериемии.
Инфекции глаз. Эти микроорганизмы могут вызывать язвы роговицы, обычно возникающие в результате травмы глаз, заканчивающиеся панофтальмитом и деструкцией глазного яблока.
Перитонит. Будучи составной частью нормальной микрофлоры кишечника, представители этих родов могут выделяться из брюшной полости после перфорации внутренних органов или инфаркта кишечника.
Инфекции мочевого тракта. Эти микроорганизмы служат основной причиной инфекционных поражений мочевого тракта, особенно у больных с хронической бактериурией, многие из которых страдают обструктивной уропатией, имеют в анамнезе сведения об инструментальном вмешательстве на мочевом пузыре и повторных курсах химиотерапии. Их часто выделяют от больных с калькулезными поражениями почек или мочевого пузыря, сопровождающимися бактериурией. Это можно объяснить уреазной активностью этих микроорганизмов, обусловливающей щелочную реакцию мочи и обеспечивающей благоприятную среду для формирования аммонийно-магниево-фосфатных камней.
Внедрение в кровоток—это наиболее серьезное проявление инфекции, вызванной представителями родов Proteus, Morganella и Providencia. В 75% случаев входными воротами инфекции служит мочевой тракт; в остальных случаях первичным фокусом являются желчные протоки, желудочно-кишечный тракт, уши, синусы, кожа. Развитию бактериемии часто предшествуют такие процедуры, как цистоскопия, катетеризация мочеточника, трансуретральная резекция предстательной железы или другие оперативные вмешательства. Клинические признаки, симптомы и лабораторные показатели сепсиса — повышение температуры тела, озноб, шок, метастатические абсцессы, лейкоцитоз и иногда тромбоцитопения — сходны с аналогичными признаками бактериемии, вызванной кишечной палочкой, клебсиеллами или другими грамотрицательными бактериями.
Диагноз инфекции, вызванной Proteus, Morganella или Providencia, зависит от результатов культурального выделения этих микроорганизмов из крови, мочи или экссудата и их идентификации с помощью соответствующих биохимических тестов. Особенно важно отделить Р. mirabilis, индол-отрицательный вид, от индол-положительных микроорганизмов, так как Р. mirabilis чувствителен к действию пенициллина и многих других антибиотиков. Представители рода протеев часто обнаруживаются в ассоциации с другими возбудителями. Особое внимание было обращено на выделение микроорганизмов, не относящихся к Р. mirabilis или Р. vulgaris, но растущих на тех же питательных средах, чтобы они не были за маски рованы ползучим ростом протея. Распространенный ползучий характер роста этих бактерий затрудняет также интерпретацию результатов определения их лекарственной чувствительности.
Большинство штаммов Р. mirabilis чувствительны к пенициллину в высоких концентрациях (10 ЕД в 1 мл или больше), к ампициллину, карбенициллина динатриевой соли, гентамицину, тобрамицину или амикацину, а также к цефалоспориновым антибиотикам. Бактериурия, вызванная Р. mirabilis, может быть быстро ликвидирована с помощью любого из перечисленных антибиотиков. Наиболее эффективен при этой форме инфекции ампициллин в дозе 0,5 г каждые 4—6 ч. При тяжелой инфекции лечение следует проводить парентерально: от 6 до 12 г ампициллина или 20000000 ЕД пенициллина G в-сочетании с тобрамицином или гентамицином в дробных дозах по 5 мг/кг в сутки, если не повреждена функция почек. Существуют некоторые данные, что при инфекциях, вызванных
P. mirabilis, аминогликозиды обладают синергическим действием с ампициллином и пенициллином G. В связи с наличием большого числа более эффективных препаратов при инфекциях, обусловленных Р. mirabilis, нет необходимости применять левомицетин. Все штаммы Р. mirabilis устойчивы к тетрациклину. Большинство же штаммов, не относящихся к Р. mirabilis, чувствительны только к аминогликозидам и цефалоспоринам третьего поколения. Карбенициллин, тикарциллин и новые уреидопенициллины эффективны в отношении штаммов, выделенных из клинического материала. В идеале терапия должна основываться на результатах определения лекарственной чувствительности in vitro, а при отсутствии их — на знании характерных образцов. Так же как и в отношении других инфекций, вызванных грамотрицательными микроорганизмами, соответствующее внимание должно быть уделено дренированию гноя, поддержанию баланса жидкости и электролитов и при наличии эндотоксического шока — лечению циркуляторного коллапса.
источник
Морганелла — условно-патогенный микроорганизм, в норме обитающий в кишечнике человека и животных. Бактерия относится к семейству Enterobacteriaceae и обладает всеми типичными свойствами, одним из которых является негативная окраска по Грамму. Эти представители нормальной флоры ЖКТ широко распространены в природе. Их можно обнаружить в загрязненной воде, почве, пищевых продуктах. В стационаре бактерии обитают на медицинском инструментарии, аппаратуре, оборудовании. Активная антибиотикотерапия и высокая устойчивость микроорганизмов к ней — факторы, обуславливающие формирование госпитальных штаммов.
Микроорганизм был открыт микробиологом из Британии Морганом в 1906 году. Он выделил микроб из фекалий больного диареей младенца, изучил и описал его свойства. Благодаря работам ученого бактерия получила свое название – Bacillus morganii. В последствии морганеллы были подробно изучены микробиологами разных стран. Одни ученые относили их к кишечным палочкам, другие – к сальмонеллам.
M. Vall в 1939 году с учетом морфологии и биохимических свойств отнес морганеллу к роду Proteus и дал название бактерии – Proteus morganii. Он обосновал свои выводы общностью ферментативных свойств микробов и способностью к ползучему росту – роению на питательных средах. Такое название бактерий долгое время использовалось в международных классификаторах и научной литературе. И только в 1984 году морганеллы были исключены из рода Proteus и официально выделены в отдельный род Morganella, представленный одним видом – Morganella morganii. Такое решение было принято на основании результатов молекулярно-биологических и генетических исследований, которые подтвердили особенности строения ДНК бактерий.
Микроорганизмы попадают в окружающую среду вместе с фекалиями больных людей или животных, являющихся источником инфекции. Морганеллы в большом количестве вызывают заболевания мочеполовых органов, становятся причиной кишечных расстройств, раневой и госпитальной инфекции. У больных появляются диспепсические симптомы, нарушение стула, интоксикация, астенизация. При поражение органов мочевыделения возникают признаки дизурии, изменяются лабораторные показатели мочи.
Диагностика заболеваний, вызванных Morganella morganii, основывается на данных, полученных при физикальном осмотре, лабораторных и инструментальных исследованиях. Ликвидация этого микроорганизма проводится консервативным путем.
Морганелла — бактерии семейства Enterobacteriaceae рода Morganella вида Morganella morganii.
Морфологические свойства микробов:
Короткие и тонкие палочки со слегка изогнутыми концами,
- Негативная окраска по Грамму,
- Одиночное или попарное расположение в мазке.
- Рост на простых питательных средах в аэробных и анаэробных условиях,
- Температурный оптимум — 37-38 градусов,
- В бульоне — равномерная муть с осадком,
- На твердых средах — выпуклые колонии округлой формы с ровным краем и блестящей поверхностью,
- Способность к переходу от S-форм в R-формы.
- Не образуют цитохромоксидазы,
- Восстанавливают нитраты в нитриты,
- Производят фермент каталазу,
- Ферментируют из сахаров только глюкозу с образованием газа,
- Образуют индол,
- Не растут на среде Симмонса,
- Расщепляют мочевину, фенилаланин, орнитин.
Морганеллы склонны к изменчивости своих основных свойств при длительном обитании во внешней среде под воздействием различных абиотических факторов.
- Соматический О-антиген,
- Жгутиковый Н-антиген,
- Поверхностный К- антиген.
Не смотря на большую неоднородность морганелл по антигенным свойствам, серологическая идентификация в практических лабораториях не проводится.
Патогенетические свойства микробов обусловлены их способностью к токсинообразованию и гемолитической активностью.
Патогенетические звенья инфекции:
- Входные ворота – ЖКТ, органы мочевыделения, рана,
- Развитие воспаления в месте внедрения,
- Выделение бактериоцинов и лейкоцидина,
- Подавление местного иммунитета,
- Формирование резистентности у бактерий к защитным факторам организма,
- Колонизация эпителия урогенитального тракта, выделение уреазы, расщепляющей мочевину, ощелачивание мочи, разрушение эпителиоцитов, воспаление,
- Развитие в кишечнике энтерита или энтероколита,
- Проникновение микробов в кровь и их распространение гематогенным путем по организму,
- Поражение внутренних органов и образование вторичных очагов инфекции,
- Развитие локальных инфекционных процессов и вторичной бактериемии.
Резервуаром инфекции являются больные люди и бактериовыделители. Особую опасность для окружающих представляют лица с кишечной формой патологии и заболеваниями урогенитального тракта. Они в огромном количестве выделяют бактерии вместе с испражнениями. При гнойно-септических процессах также происходит значительное выделение морганелл.
Наибольшей восприимчивостью к инфекции обладают:
- Маленькие дети и пожилые люди,
- Больные с патологией органов мочевыделения,
- Лица с тяжелыми хроническими болезнями,
- Перенесшие оперативные вмешательства или тяжелые инвазивные манипуляции,
- Пациенты с иммунодефицитом.
Инфекция распространяется фекально-оральным механизмом, который реализуется контактным путем при непосредственном контакте — через грязные руки, а также пищевым путем — через обсемененные продукты питания.
Морганелла morganii — возбудитель целого ряда заболеваний:
- Мочевыделительной системы — цистита, уретрита, простатита;
- Пищеварительной системы — энтерита, энтероколита;
- Нервной системы — менингита, эндофтальмита;
- Органов дыхания — синуситов, пневмонии;
- Септических состояний — перитонита, фасциита, артрита, остеомиелита, сепсиса;
- Нозокомиальной хирургической и раневой инфекции.
Чаще всего поражается ЖКТ, на втором месте — урогенитальный тракт.
Острая кишечная инфекция, вызванная морганеллой, начинается с интоксикации:
- Лихорадки,
- Озноба,
- Миалгии и артралгии,
- Потливости.
Затем присоединяются диспепсические явления:
- Отсутствие аппетита,
- Тошнота,
- Повторная рвота,
- Метеоризм,
- Урчание.
Диарейный синдром характеризуется:
- Появлением жидкого стула желтого или зеленого цвета,
- Наличием в кале непереваренных комочков пищи и патологических примесей — слизи и гноя.
Каждый поход в туалет сопровождается режущей и схваткообразной болью в животе.
Дети первого года жизни очень тяжело переносят инфекцию. У них развивается обезвоживание: кожа и слизистые становятся сухими, неэластичными, снижается тургор мягких тканей, происходит потеря веса. Возникают нарушения со стороны сердечно-сосудистой и дыхательной систем, что проявляется одышкой, учащенным сердцебиением, шумами в сердце, признаками пневмонии. Дети отказываются от груди и становятся вялыми.
Инфекция, вызванная морганеллой, протекает в форме энтерита, реже – энтероколита. При затяжном воспалении на стенках кишечника появляются глубокие язвы.
Чтобы обнаружить морганеллу в биоматериале, необходимо провести его микробиологическое исследование. В каждом конкретном случае схема посева будет отличаться. Это зависит от локализации очага поражения и характера течения инфекционного процесса. Обычно в баклабораторию доставляют фекалии, рвотные массы, мочу, кровь, отделяемое ран, экссудат. Если в результате анализа кала была обнаружена морганелла в количестве более 10 5 степени колониеобразующих единиц, значит эта бактерия стала причиной инфекционного процесса.
Обнаружение в моче человека морганеллы 10 5 степени и более — признак воспаления мочевыводящих путей. Если в моче присутствуют бактерии в меньшей концентрации, это указывает на наличие бактериального загрязнения — контаминацию мочи, обусловленную нарушением правил ее забора.
Серодиагностика имеет большое значение. С кровью больного ставят реакцию агглютинации на 5 или 6 день болезни, а также реакцию связывания комплимента и пассивной гемагглютинации.
Вспомогательное значение в диагностике заболеваний, вызванных морганеллой, имеют общеклинический и биохимический анализы крови, мочи, а также инструментальные методики.
- В общеклиническом анализе крови выявляют признаки бактериального воспаления – лейкоцитоз, сдвиг формулы влево, увеличение СОЭ.
- Биохимическое исследование крови проводится по показаниям.
- Инструментальные методы, позволяющие определить тяжесть состояния пациента и поражение внутренних органов — рентгенография, УЗИ, эндоскопия, томография.
Лечение заболеваний, вызванных морганеллой моргани, этиотропное противомикробное. Больным назначают антибиотики из группы цефалоспоринов, фторхинолонов, аминогликозидов, защищенных пенициллинов, макролидов. Для усиления эффективности проводимой терапии целесообразно сочетанное применение антибактериальных препаратов.
Больным показан прием про- и пребиотиков, а также синбиотиков для восстановления микрофлоры кишечника после тяжелого заболевания и активной антибиотикотерапии. Наиболее популярными препаратами этих групп являются: «Линекс», «Аципол», «Бифиформ», «Хилак форте».
Симптоматическое лечение кишечной инфекции:
-
Препараты, снижающие температуру и уменьшающие боль – «Нурофен», «Ибуклин», «Парацетамол»;
- Энтеросорбенты – «Энтеросгель», «Смекта», «Полисорб»;
- Лекарства от поноса – «Лоперамид», «Имодиум»;
- Средства от тошноты и рвоты – «Церукал», «Мотилиум»;
- Спазмолитики – «Дротаверин», «Дюспаталин».
Тяжелые формы патологии, особенно у новорожденных детей, требуют проведения патогенетического лечения, направленного на устранение обезвоживания и коррекции водно-электролитного баланса. Для этого перорально принимают «Регидрон», а парентерально вводят физраствор с глюкозой, коллоидные и кристаллоидные растворы.
Лечение любой кишечной инфекции включает диетотерапию. Из рациона больных необходимо исключить острую и соленую пищу, копчености, маринады, пряности, жареные и жирные блюда, сладости, сдобу, алкоголь. Больным необходимо щадящее питание, особенно в первые дни болезни. Полезны легкие перетертые супы, пюре, обволакивающие каши, рисовый отвар. Диетотерапия повышает эффективность лечебных процедур и способствует скорейшему выздоровлению.
Прогноз инфекции, вызванной морганеллой, благоприятный. Тяжелые формы патологии у детей и ослабленных лиц могут привести к развитию осложнений — обезвоживания и кахексии. Острые энтериты и энтероколиты обычно заканчиваются выздоровлением. Поражение мочевыделительной системы отличается упорным течением с частыми рецидивами. Сформировавшееся вялотекущее воспаление почек тяжело поддается терапии.
Острую кишечную инфекцию любой этиологии по праву называют «болезнью грязных рук». Чтобы предупредить ее развитие, необходимо соблюдать правила личной гигиены, а также основные санитарно-гигиенические и противоэпидемические мероприятия. Необходимо тщательно мыть руки перед едой и после возвращения с прогулки, мыть овощи и фрукты, соблюдать режимы термической обработки мясных и молочных продуктов, содержать в чистоте жилице и прилегающую территорию.
Огромную роль в развитии инфекционное патологии играет состояние иммунной системы. Для укрепления иммунитета следует вести здоровый образ жизни, правильно питаться, закаляться, заниматься спортом, бороться с вредными привычками, полноценно высыпаться и иметь оптимальный режим труда и отдыха.
Большое значение для здоровья человека имеет своевременное выявление и лечение хронических заболеваний, санация очагов инфекции в организме, исключение контактов с зараженными людьми, ежегодное посещение врача-инфекциониста, прием антибиотиков только по назначению врача.
Для ликвидации госпитальной инфекции, вызванной морганеллой, разработаны специальные мероприятия, которые проводятся в роддомах и урологических отделениях. Они заключаются в соблюдении правил асептики и антисептики, проведении дезинфекции, ограничении инвазивных манипуляций, обследовании медперсонала на носительство болезнетворных бактерий.
Исключение стрессов и нервных нагрузок, а также профилактический прием витаминно-минеральных комплексов дополняют общий перечень необходимых общеукрепляющих и профилактических мероприятий.
источник
Род Proteus семейства Enterobacteriaceae включает грамотрицательные бактерии, не ферментирующие лактозу и характеризующиеся активной подвижностью и ползучим распространяющимся ростом на поверхности плотных питательных сред. Микроорганизмы, которые ранее были классифицированы и отнесены к роду Proteus, после недавно проведенного детального изучения ДНК получили новые названия. Р. morganii был классифицирован как Morganella morganii, тогда как некоторые биогруппы В. rettgeri были реклассифицированы как Providencia stuartii и Providencia rettgeri. P. mirabilis и Р. vulgaris сохранили свою номенклатуру. Р. mirabilis вызывает 75—90% инфекций человека и отличается от других упомянутых микроорганизмов тем, что не обладает способностью образовывать индол. Все четыре вида расщепляют мочевину с образованием аммония. Некоторые штаммы Р. vulgaris имеют общий антиген с определенными риккетсиями, за счет которого объясняется появление антител к протеям (реакция Вейля — Феликса) при тифе, японской речной лихорадке (цуцугамуши) и лихорадке Скалистых гор. Микроорганизмы, объединяемые в группу Providencia, очень тесно примыкают к представителям рода протеев, отличаясь от них только некоторыми биохимическими свойствами.
Эти микроорганизмы в норме обнаруживаются в почве, воде и сточных водах и входят в состав нормальной флоры кишечника. Иногда им приписывают этиологическую роль при диареях детей раннего возраста, но это не получило достаточных подтверждений. Их часто обнаруживают в посеве из отделяемого поверхностных ран, дренированных полостей среднего уха и из мокроты, особенно у больных, получавших антибиотики. В подобных условиях они замещают более чувствительную флору, погибающую под действием этих препаратов.
Указанные микроорганизмы редко служат причиной первичного поражения. Обычно они вызывают заболевание в участках, ранее инфицированных другими возбудителями: на коже, в ушах, сосцевидном отростке, синусах, глазах, брюшной полости, костях, мочевом тракте, мозговых оболочках, легких, кровяном русле.
Кожные инфекции. Эти микроорганизмы присутствуют в отделяемом хирургических ран, особенно после антимикробной терапии, но никогда не присоединяются к нормальной раневой микрофлоре, если происходит нормальное заживление, ткани жизнеспособны и нет инородных тел. Часто в ассоциации с другими грамотрицательными бактериями или стафилакокками они могут инфицировать ожоговые поверхности, варикозные раны, язвы, образующиеся при пролежнях.
Инфекции уха и сосцевидного синуса. Воспаление среднего уха и мастоидит, особенно вызванные Р. mirabilis, могут привести к обширной деструкции среднего уха и сосцевидного синуса. Зловонные выделения, холестеатома и грануляционная ткань составляют хронический фокус инфекции в среднем и внутреннем ухе и в сосцевидном отростке, в результате чего развивается глухота. В качестве случайного осложнения возможно развитие паралича лицевого нерва. Основная опасность этих инфекций заключается в возможности их распространения в полость черепа, что ведет к тромбозу бокового синуса, менингиту, абсцессу мозга и бактериемии.
Инфекции глаз. Эти микроорганизмы могут вызывать язвы роговицы, обычно возникающие в результате травмы глаз, заканчивающиеся панофтальмитом и деструкцией глазного яблока.
Перитонит. Будучи составной частью нормальной микрофлоры кишечника, представители этих родов могут выделяться из брюшной полости после перфорации внутренних органов или инфаркта кишечника.
Инфекции мочевого тракта. Эти микроорганизмы служат основной причиной инфекционных поражений мочевого тракта, особенно у больных с хронической бактериурией, многие из которых страдают обструктивной уропатией, имеют в анамнезе сведения об инструментальном вмешательстве на мочевом пузыре и повторных курсах химиотерапии. Их часто выделяют от больных с калькулезными поражениями почек или мочевого пузыря, сопровождающимися бактериурией. Это можно объяснить уреазной активностью этих микроорганизмов, обусловливающей щелочную реакцию мочи и обеспечивающей благоприятную среду для формирования аммонийно-магниево-фосфатных камней.
Внедрение в кровоток—это наиболее серьезное проявление инфекции, вызванной представителями родов Proteus, Morganella и Providencia. В 75% случаев входными воротами инфекции служит мочевой тракт; в остальных случаях первичным фокусом являются желчные протоки, желудочно-кишечный тракт, уши, синусы, кожа. Развитию бактериемии часто предшествуют такие процедуры, как цистоскопия, катетеризация мочеточника, трансуретральная резекция предстательной железы или другие оперативные вмешательства. Клинические признаки, симптомы и лабораторные показатели сепсиса — повышение температуры тела, озноб, шок, метастатические абсцессы, лейкоцитоз и иногда тромбоцитопения — сходны с аналогичными признаками бактериемии, вызванной кишечной палочкой, клебсиеллами или другими грамотрицательными бактериями.
Диагноз инфекции, вызванной Proteus, Morganella или Providencia, зависит от результатов культурального выделения этих микроорганизмов из крови, мочи или экссудата и их идентификации с помощью соответствующих биохимических тестов. Особенно важно отделить Р. mirabilis, индол-отрицательный вид, от индол-положительных микроорганизмов, так как Р. mirabilis чувствителен к действию пенициллина и многих других антибиотиков. Представители рода протеев часто обнаруживаются в ассоциации с другими возбудителями. Особое внимание было обращено на выделение микроорганизмов, не относящихся к Р. mirabilis или Р. vulgaris, но растущих на тех же питательных средах, чтобы они не были за маски рованы ползучим ростом протея. Распространенный ползучий характер роста этих бактерий затрудняет также интерпретацию результатов определения их лекарственной чувствительности.
Большинство штаммов Р. mirabilis чувствительны к пенициллину в высоких концентрациях (10 ЕД в 1 мл или больше), к ампициллину, карбенициллина динатриевой соли, гентамицину, тобрамицину или амикацину, а также к цефалоспориновым антибиотикам. Бактериурия, вызванная Р. mirabilis, может быть быстро ликвидирована с помощью любого из перечисленных антибиотиков. Наиболее эффективен при этой форме инфекции ампициллин в дозе 0,5 г каждые 4—6 ч. При тяжелой инфекции лечение следует проводить парентерально: от 6 до 12 г ампициллина или 20000000 ЕД пенициллина G в-сочетании с тобрамицином или гентамицином в дробных дозах по 5 мг/кг в сутки, если не повреждена функция почек. Существуют некоторые данные, что при инфекциях, вызванных
P. mirabilis, аминогликозиды обладают синергическим действием с ампициллином и пенициллином G. В связи с наличием большого числа более эффективных препаратов при инфекциях, обусловленных Р. mirabilis, нет необходимости применять левомицетин. Все штаммы Р. mirabilis устойчивы к тетрациклину. Большинство же штаммов, не относящихся к Р. mirabilis, чувствительны только к аминогликозидам и цефалоспоринам третьего поколения. Карбенициллин, тикарциллин и новые уреидопенициллины эффективны в отношении штаммов, выделенных из клинического материала. В идеале терапия должна основываться на результатах определения лекарственной чувствительности in vitro, а при отсутствии их — на знании характерных образцов. Так же как и в отношении других инфекций, вызванных грамотрицательными микроорганизмами, соответствующее внимание должно быть уделено дренированию гноя, поддержанию баланса жидкости и электролитов и при наличии эндотоксического шока — лечению циркуляторного коллапса.
источник
 Препараты, снижающие температуру и уменьшающие боль – «Нурофен», «Ибуклин», «Парацетамол»;
Препараты, снижающие температуру и уменьшающие боль – «Нурофен», «Ибуклин», «Парацетамол»;