В МОДИФИКАЦИИ ХУЗЕ
Техника окраски:
1. Мазок окрашивают карболовым фуксином Циля (основной краситель) при нагревании 3-5 минут или окрашенной фуксином бумагой до появления паров, но, не доводя краситель до кипения.
2. Препарат остудить, снять бумагу, слить краситель и промыть водой.
3. Обесцвечивают 5% раствором серной кислоты (дифференцирующее вещество) в течение 1-2 мин.
3. Остаток кислоты слить, препарат промыть водой и обработать этанолом 20 сек.
4. Докрашивают 3-5 мин водным раствором метиленового синего Леффлера (дополнительный краситель).
5. Препарат промыть водой, подсушить и микроскопировать.
Оценка результатов. М. tuberculosis к этанолу устойчивы и не обесцвечиваются, оставаясь красными. М. smagmatis под влиянием спирта эту краску теряют, но при докраске метиленовой синью становятся синими.
Приложение 3
ОКРАСИТЬ МАЗОК ИЗ ДРОЖЖЕИ ПО ПЕШКОВУ (выявление оболочки)
Техника окраски :
1) Приготовленный мазок фиксируют над пламенем спиртовки.
2) На фиксированный мазок наливают метиленовый синий Леффлера и кипятят над пламенем спиртовой горелки 20 — 30 секунд.
3) Остывший препарат промывают водой и докрашивают 0,5% раствором нейтрального красного в течение 30 – 60 секунд.
4) Опять промывают дистиллированной водой и высушивают на воздухе.
5) Микроскопируют с иммерсией.
Оценка результатов . Споры окрашиваются в голубой, либо в синий цвет. Протоплазма вегетативного тела бактерий — розовая или красная.
Приложение 4
А) ОКРАСКА НУКЛЕОИДА БАКТЕРИЙ ЯДРОТРОПНЫМ
МЕТОДОМ ФЕЛЬГЕНА
Техника окраски :
1) Приготовить препарат из бактериальной культуры или дрожжей.
2) Высушить, зафиксировать в жидкости Карнуа 7 мин.
4) Обработать 1 N НСl, подогретой до 60 0 С, в течение 7 мин, затем опустить препарат на 1-2 мин в холодную 1N HCl.
5) Обработать фуксинсернистой кислотой (реактив Шиффа) в течение 3-4 часов.
6) Промыть водой, высушить, микроскопировать с иммерсией.
Оценка результата. Ядерное вещество окрашено в фиолетовый цвет.
Б) ОКРАСКА НУКЛЕОИДА БАКТЕРИЙ ПО РОМАНОВСКОМУ – ГИМЗА
Техника окраски:
1) приготовленный препарат высушивают на воздухе;
2) фиксируют жидкостью Карнуа или смесью Никифорова;
3) фиксированные мазки подсушивают на воздухе и окрашивают рабочим раствором Романовского — Гимзы (к 10 мл дистиллированной воды добавляют 10 капель коммерческого красителя Романовского — Гимзы), погружая стекло в стаканчик с красителем.
4) Через 1 ч краситель сливают, и препарат промывают дистиллированной водой.
5) Готовый препарат высушивают на воздухе и микроскопируют.
Оценка результатов. Протоплазма форменных элементов ткани окрашивается в голубовато-синий цвет, ядра клеток — в фиолетово-красный, тела микробных клеток приобретают фиолетово-красный цвет.
Приложение 5
А) ВЫЯВЛЕНИЕ ЗЁРЕН ВОЛЮТИНА ПО НЕЙССЕРУ
Техника окраски:
1. Готовят мазок, высушивают, фиксируют жаром.
2. Наливают на мазок 1-2 капли уксуснокислого метиленового синего Нейссера, красят 1 — 2 минуты.
3. Краску сливают, наносят раствор Люголя на 1 мин.
4. Промывают водой, подсушивают фильтровальной бумагой.
5. Наносят раствор везувина (хризоидина) для окраски тела бактерии на 1 – 3 мин.
6. Смывают водой, высушивают, микроскопируют.
Оценка результатов. В мазке цитоплазма бактерий окрашивается в жёлто-коричневый цвет, зёрна волютина — от сине-зелёного до сине-чёрного цвета.
Б) ВЫЯВЛЕНИЕ ЗЁРЕН ВОЛЮТИНА ПРОСТЫМ МЕТОДОМ ЛЕФФЛЕРА
Техника окраски:
1. Исследуемый материал наносят на чистые обезжиренные предметные стекла, растирают его тонким равномерным слоем по поверхности стекла, высушивают на воздухе.
2. Препарат фиксируют 3 мин в 96% этиловом спирте и высушивают.
3. На высушенный препарат наносят каплю 1% щелочного раствора метиленового синего по Леффлеру и окрашивают в течение 3 — 10 минут.
3. Промывают погружением в стакан с водопроводной водой.
4. Высушивают на воздухе и микроскопируют с иммерсионной системой.
Оценка результата . При правильном окрашивании в микроскопируемом препарате видны голубые бактерии на бесцветном или слабо голубом фоне.
Приложение 6
Последнее изменение этой страницы: 2019-04-10; Просмотров: 29; Нарушение авторского права страницы
источник
1. Бактерии, содержащие большое количество жиро- и воскоподобных веществ, а также миколовую кислоту в клеточной стенке и цитоплазме (туберкулезные и лепрозные палочки), являются кислотоустойчивыми и не могут быть окрашены простыми методами. Их окрашивают по методу Циля-Нильсена.
2. При окраске бактерий по методу Циля-Нильсена используют концентрированные растворы, содержащие протравы (5 % карболовый фуксин Циля) и ведут окраску при подогревании. Карболовая кислота разрыхляет клеточную стенку и повышает ее тинкториальные свойства. Высокая концентрация красителя и нагревание усиливают реакцию его взаимодействия с миколовой кислотой. Затем препарат обесцвечивают 5 % раствором серной кислоты и докрашивают метиленовым синим по Леффлеру. Кислотоустойчивые бактерии окрашиваются в красный цвет (цвет фуксина), т.к. миколовая кислота вступает во взаимодействие с карболовым фуксином. В результате краска фиксируется в микробной клетке, поэтому кислотоустойчивые палочки не обесцвечиваются серной кислотой. Остальные бактерии обесцвечиваются и докрашиваются в синий цвет метиленовым синим. Благодаря этому кислотоустойчивые бактерии могут быть дифференцированы от других.
3. Техника окраски по Цилю-Нильсену. Фиксированный мазок покрывают фильтровальной бумагой, на которую наливают карболовый фуксин Циля. Затем мазок подогревают над пламенем горелки до появления паров. Добавляют новую порцию красителя и повторяют манипуляцию в течение 3-5 минут. Снимают бумажку пинцетом и после охлаждения до комнатной температуры тщательно промывают мазок водой. Обесцвечивают мазок 5 % раствором серной кислоты, опуская в него предметное стекло на 20-30 минут. Затем препарат тщательно промывают водой. В течение 5 минут окрашивают раствором метиленового синего по Леффлеру, промывают водой и высушивают фильтровальной бумагой.
СТРОЕНИЕ, ОБРАЗОВАНИЕ, ЗНАЧЕНИЕ И МЕТОДЫ ОКРАСКИ СПОР У БАКТЕРИЙ.
1. Спорообразование свойственно не всем бактериям. Споры образуют почти исключительно палочковидные бактерии. Среди кокков споры образуют энтерококк и мочевая сарцина, и только один из вибрионов образует спору при температуре 45-55° С.
2.Спорообразующие аэробные палочки, у которых размеры споры не превышают диаметра клетки, называются бациллами (возбудитель сибирской язвы). Спорообразующие анаэробные бактерии, у которых размер споры превышает диаметр клетки, называются клостридиями (возбудители столбняка, ботулизма, газовой гангрены).
3. Споры образуются внутри тела бактерии, т.е. эндогенно при неблагоприятных внешних условиях (недостаток питательных веществ, наличие вредных продуктов обмена, высушивание, изменение аэрации, неблагоприятная температура). Одна бактериальная клетка способна образовывать только одну спору. Т.о., споры являются приспособлением к перенесению неблагоприятных условий, а не служат для размножения (исключение – актиномицеты).
4. В отличие от вегетативных форм, которые являются активной стадией бактериальной клетки, когда энергично проявляются все физиологические и биохимические процессы, спора – это покоящаяся форма, в которой отсутствуют ферментативная и другие виды активности и которая обладает высокой устойчивостью к действию повреждающих факторов, что обусловлено определенными физико-химическими и биологическими особенностями спор. Они могут сохранять свою жизнеспособность в течение длительного времени (например, споры возбудителей сибирской язвы и столбняка способны сохраняться в почве десятки лет). Образование спор способствует сохранению вида.
5. Образование спор у патогенных микробов происходит вне организма человека и животных; у одних микробов – при хорошем доступе кислорода; у других – при отсутствии кислорода. К спорообразованию способны только зрелые клетки бактерий.
6. Процесс спорообразования протекает в течение 18-20 часов следующим образом: в цитоплазме появляется уплотненный участок, окружающий нуклеоид; он обособляется от основной цитоплазмы при помощи цитоплазматической мембраны и образуется проспора, а затем формируется многослойная оболочка. Цитоплазматическая мембрана обрастает проспору, и образуется двойная мембрана. Между мембранами образуется кортекс из пептидогликана, а сверху спора покрывается оболочкой, пропитанной жирами, смолистыми веществами и дипиколинатом кальция. Вегетативная часть клетки лизируется, и спора освобождается. Наружный слой оболочки споры трудно проницаем для воды и различных веществ, а из внутреннего слоя при прорастании споры образуется клеточная стенка бактерии.
7. Химический состав споры характеризуется незначительным количеством свободной воды (цитоплазма сгущена по сравнению с вегетативной клеткой и содержит воду в связанном состоянии), большим содержанием липидов. Плотная многослойная оболочка обусловливает высокую устойчивость спор к воздействию неблагоприятных физических и химических факторов – высушиванию, воздействию УФ лучей, замораживанию и кипячению, действию спиртов и других химических веществ. Термоустойчивость спор связывают с наличием в оболочке дипиколината кальция. Споры погибают в автоклаве при 120° С в течение 15-20 минут и при действии сухого жара (150-170° С) в течение 1-2 часов.
8. Спорообразование, форма и расположение спор в клетке являются довольно постоянным видовым признаком бактерии, что позволяет отличать их друг от друга. Форма спор может быть круглой или овальной. Расположение спор в клетке бывает: центральное (сибиреязвенная бацилла); терминальное – на конце палочки (возбудитель столбняка); субтерминальное – ближе к концу палочки (возбудитель ботулизма, газовой гангрены). Диаметр споры обычно не превышает поперечника палочки, и форма клетки в процессе спорообразования не изменяется (сибиреязвенная бацилла). Однако спора может быть шире поперечника клетки, и если она располагается в центре клетки, палочки приобретают веретеновидную форму (возбудитель газовой гангрены), а если спора находится на конце клетки, то она приобретает форму барабанной палочки (возбудитель столбняка).
9. В благоприятных условиях спора прорастает и превращается в вегетативную форму, проходя три стадии: активацию, инициацию и вырастание. При этом из споры в течение 4-5 часов образуется одна бактериальная клетка. Активация – готовность к прорастанию. Она ускоряется после прогревания при температуре 60-80° С. Инициация длится несколько минут. Вырастание характеризуется быстрым ростом, оболочка споры набухает за счет поглощения воды, а затем внутри споры усиливается активность ферментов, гидролизующих оболочку споры, и в образовавшееся отверстие выходит наружу бактериальный проросток, одетый в тонкую оболочку. Из него формируется вегетативная клетка, приступающая к размножению.
10. Малая проницаемость оболочки спор является причиной того, что при обычных методах окраски они остаются бесцветными. В неокрашенном состоянии спора сильно преломляет свет и видна внутри или вне бактериальной клетки в виде блестящего тельца.
Для окраски спор используют энергичные воздействия, приводящие к разрыхлению оболочки – сильные красители (5 % карболовый фуксин Циля) и подогревание. Медленно воспринимая краску, спора после этого с трудом отдает ее обесцвечивающим растворам (5 % H2SO4). При окраске спор по методу Ожешки, оболочку споры протравливают действием HCl при подогревании. Приготовленный мазок высушивают, но не фиксируют. На мазок наливают 0,5 % раствор HCl, подогревают 1-2 минуты и сливают кислоту. Мазок промывают водой, просушивают, фиксируют над пламенем спиртовки. Далее окраску ведут методом Циля-Нильсена. Споры после обработки серной кислотой не обесцвечиваются и имеют красный цвет, а вегетативные формы после обесцвечивания докрашиваются метиленовым синим и имеют синий цвет.
11. В природе споровые микробы имеют широкое распространение: они встречаются в воздухе, воде, особенно в почве. Среди споровых бактерий имеются и болезнетворные.
О спорообразовании того или иного возбудителя инфекции надо хорошо знать, т.к. в связи с высокой резистентностью спор методы борьбы с инфекциями намного усложняются и применяются специальные способы стерилизации.
О жизнедеятельности и широком распространении споровых бактерий необходимо постоянно помнить при изготовлении лекарственных препаратов, растворов для подкожного или внутривенного введения, а также при заготовке перевязочного материала.
12. Способность к спорообразованию является довольно стойким видовым признаком целого ряда палочковидных бактерий. Но при некоторых условиях могут быть получены новые формы, навсегда утратившие способность к образованию спор. Например, Л. Пастером была получена неспорогенная вакцина из культуры бацилл сибирской язвы, выращиваемой при 42°С в течение 12-24 дней.
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
источник
Окраска по Цилю-Нильсену – это один из методов, используемый для обнаружения при исследовании анализов больного различных заболеваний. В случае изучения мокроты пациента на предмет наличия возбудителей, к примеру, туберкулеза широко используется данный метод. В этой статье пойдет речь о нюансах его проведения, а также о некоторых аналогичных методах.
Этот метод окрашивания используется в тех случаях, когда необходимо выявить в образце кислотоустойчивые микроорганизмы, к которым относятся возбудители туберкулеза, проказы и микробактериозов. Такие бактерии характеризуются, прежде всего, медленной скоростью роста, общими морфологическими особенностями, а также устойчивостью к кислотам и некоторым другим химическим веществам. Из-за последнего свойства такие бактерии плохо поддаются окраске обычными разведенными красителями. Для окрашивания таких бактерий на препарат наносится и в дальнейшем поджигается фуксин Циля, причем полученная окраска не исчезает под воздействием спирта и кислот.
Для проведения окраски образца по методу Циля-Нильсена необходимы следующие реактивы:
- Метиленовый синий с 10%-ным содержанием спирта;
- Раствор солянокислого спирта;
- Фуксин Циля, состоящий из фенола, фуксина и этилового спирта в количестве 50 г, 10 г и 10 г соответственно.
Также потребуется следующие инструменты:
- Газовая горелка;
- Часы для слежения за временем;
- Вода;
- 96%-ный этиловый спирт;
- Перчатки.
Окрашивание по методу Циля-Нильсена состоит из следующих этапов:
- На мазок, находящийся на предметном стекле, накладывается фильтровальная бумага, на которую затем наносится небольшое количество фуксина Циля.
- Затем предметное стекло нагревается до появления характерного пара. После появления пара стеклу нужно дать остыть. Затем нужно повторить эту процедуру еще 2 раза, а затем дать подогретому мазку остыть.
- После этого нужно смыть фуксин с приборного стекла, предварительно убрав бумагу, с помощью дистиллированной воды.
- Затем стекло помещается в раствор соляной или серной кислоты до полного обесцвечивания.
- Наконец, на обесцвеченный препарат наносится раствор метиленового синего. Стекло промывается дистиллированной водой и высушивается для дальнейшего исследования образца под микроскопом.
Липиды, которые содержатся в клеточной стенке кислотоустойчивых бактерий, хорошо удерживают цвет основного красителя. В некислотоустойчивых бактериях стабильно удерживается цвет как основного красителя, так и дополнительного.
При подозрениях на туберкулез исследуется мокрота больного. Длительный кашель с обильными выделениями является показанием для проведения подобного исследования. Визуально наличие возбудителей туберкулеза в организме может выдать мокрота характерной жидкой, пенистой консистенции и признаками гноя, а также мокрота, смешанная с кровью. Обнаружение возбудителей туберкулеза – рисовидных телец, известных также как линзы Коха, облегчается при использовании методов окраски образца. Таких как вышеописанный метод Циля-Нильсена или метод Грама, суть которого будет описана ниже.
Окраска препарата по методу Грама проводится следующим образом:
- Сперва препарат обрабатывается раствором Люголя на протяжении минуты;
- Затем препарат обесцвечивается с использованием спирта;
- Наконец, препарат промывается с использованием воды и дополнительно окрашивается фуксином.
Классификацию бактерий на грамположительные и на грамотрицательные можно наглядно увидеть при проведении подобной окраски. Первый тип бактерий окрашивается в темно-фиолетовый цвет, тогда как второй тип – в красный цвет. Исходя из такой классификации, можно судить о химическом составе клеточной стенки бактерии и о других ее характерных свойствах.
Анализ мокроты пациента является жизненно необходимым для своевременного выявления заболеваний, затрагивающих дыхательные пути, в том числе и туберкулеза. Окрашивание по методу Циля-Нильсена помогает выявить микроорганизмы и возбудители подобных болезней. В том числе и в случаях, когда речь идет об атипичных бактериях. Тем самым позволяет производить более точную и качественную диагностику подобных болезней.
Если вы сталкивались с подобными заболеваниями, знакомы с техниками исследования анализов больного на предмет наличия в них возбудителей инфекции или же у вас есть вопрос по теме, вы можете оставить свой комментарий.
источник
Для проведения данных исследований необходимо следующее оснащение рабочего места:
- Предметные и покровные стекла.
- Шпатели и иглы.
- Смесь Никифорова.
- Газовая или спиртовая горелка.
- Пастеровская пипетка с резиновым баллончиком.
- Водяная баня с мостиком.
- Иммерсионное масло.
- Микроскоп.
- Фильтровальная бумага.
- Пинцеты Корне.
- Бумажки Синева.
- Основной фуксин.
- 96° этиловый спирт.
- Фенол.
- Глицерин.
- Концентрированная соляная кислота.
- Метиленовая синька.
- Дистиллированная вода.
- Генцианвиолет.
- Реактив Люголя.
- Едкий натр (NaOH).
- Бензин или ксилол.
Для бактериоскопического исследования готовят обычно два препарата: один для обнаружения микобактерий туберкулеза и другой для обнаружения прочих микроорганизмов. Для первого препарата отбирают те же частицы, которые были предназначены для микроскопии, для второго — гнойные частицы. Взятый материал распределяют по предметному стеклу до получения достаточно тонкой ажурной сеточки (материал на первом стекле распределяют на 2/3 его поверхности, на втором — в центре).
Оба препарата фиксируют троекратным проведением над пламенем горелки. Первый препарат окрашивают по Цилю — Нильсену, второй — по Граму.
Для окраски препаратов по Цилю-Нильсену необходимы следующие краски и реактивы:
- Фуксин Циля: основного фуксина 1 г, глицерина 4 капли, этилового спирта 96° 10 мл, карболовой кислоты (5% раствор фенола) 5 мл, дистиллированной воды 90 мл. К фуксину, помещенному в фарфоровую ступку, прибавляют глицерин, хорошо растирают, постепенно приливают карболовую кислоту, спирт и воду. Фильтруют.
- 3% раствор солянокислого спирта: 3 мл концентрированной соляной кислоты удельного веса 1,19 и 97 мл 96° этилового спирта.
- 0,2 % водный раствор метиленовой синьки — 1 г метиленовой синьки растворяют в 500 мл дистиллирован- вой воды.
Техника окраски . На фиксированный препарат кладут полоску фильтровальной бумаги (уже и короче предметного стекла), на которую наливают в избытке фуксин Циля. Затем препарат нагревают до появления паров (достаточно троекратно медленно провести его над пламенем горелки), дают ему остыть в течение 3-5 минут, сбрасывают с помощью пинцета бумажку, промывают препарат водой и наливают на него 3% раствор солянокислого спирта для обесцвечивания на 20 секунд. После этого препарат промывают водой и вновь повторяют обесцвечивание. Материал должен быть серовато-розового цвета. Затем на препарат на 20-30 секунд наливают 1: 500 водный раствор метиленовой синьки, краску сливают, препарат промывают водой и высушивают, установив в вертикальном положении на полоску фильтровальной бумаги.
Высушенный препарат рассматривают под микроскопом с иммерсией, с поднятым конденсором.
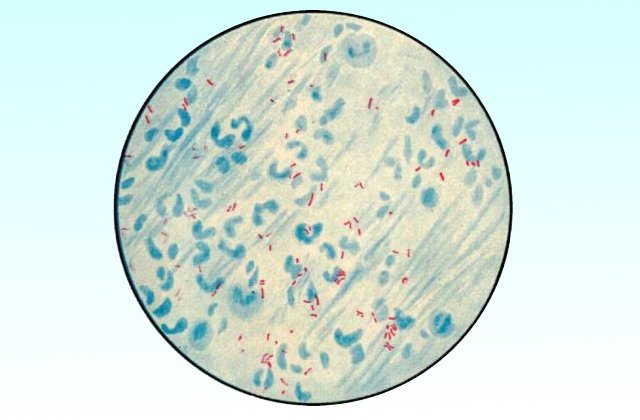
В препарате микобактерии туберкулеза (рис. 60) красного цвета, нежные, тонкие, слегка изогнутые, иногда зернистые. Иногда обнаруживают микобактерип туберкулеза в виде так называемых осколков (в составе тетрады Эрлиха).
Рис. 60. Микобактерии туберкулеза в мокроте. 1 — окраска по Цилю-Нильсену, 2 — в люминесцентном микроскопе.
Все остальные элементы, в том числе и другие микроорганизмы, окрашены в синий цвет. С целью обнаружения мпкобактерий туберкулеза препарат тщательно исследуют, продвигая от одного продольного края к другому и поперек мазка. Во всех сомнительных случаях рекомендуют обработать препараты жавелевой водой
Результат исследования оформляют, используя следующую формулировку: «микобактерип туберкулеза не обнаружены» или «микобактерип туберкулеза обнаружены», и отмечают приблизительное их количество, например, «единичные в препарате», «единичные в поле зрения» и т. д.
В настоящее время находит все большее распространение люминесцентный способ обнаружения микобактерий туберкулеза в мокроте. Микобактерип туберкулеза имеют золотисто-желтое свечение на черном фоне препарата (рис. 60, 2).
В тех случаях, когда количество микобактерий туберкулеза в мокроте незначительно, для их обнаружения применяют метод обогащения (флотация), который состоит в следующем. В бутылку с нешироким горлышком (емкостью 250 мл) помещают 12-20 мл мокроты, добавляют равный объем 0,5% раствора КОН и встряхивают 5-10 минут. Затем приливают около 10 мл дистиллированной воды и 0,5-1 мл бензина или ксилола, взбалтывают 10-15 минут и доливают дистиллированную воду гак, чтобы горлышко бутылки было заполнено. Смесь оставляют на 1-2 часа до образования на поверхности жидкости сливкообразного слоя. На два предметных стекла, заранее расположенных на мостике над водяной баней, нагретой до 60-65°, каплями, с помощью пастеровской пипетки, 5-6 раз наносят сливкообразный слой, каждый раз после подсыхания предыдущей капли. Мазки окрашивают фуксином Циля на водяной бане (без дополнительной фиксации) в течение 10 минут, промывают водой, 3-4 минуты обесцвечивают 3% раствором солянокислого спирта, вновь обмывают водой, докрашивают 0,2% водным раствором метиленовой синьки, высушивают и исследуют под микроскопом.
Для окраски препаратов по Граму требуются следующие краски и реактивы:
- Разведенный фуксин Циля (фуксин Пфейффера): 1 часть фуксина Циля + 9 частей дистиллированной воды.
- Реактив Люголя.
- 1 % спиртовой раствор генцианвиолета — 1 г генцианвиолета растворяют в 100 мл 96° этилового спирта. Этот раствор краски можно заменить бумажкой, приготовленной по методу Синева (белую фильтровальную бумажку пропитывают 1% спиртовым раствором генцианвиолета, затем высушивают и разрезают на мелкие квадратики соответственно размеру мазка).
Техника окраски . На фиксированный препарат накладывают бумажку Синева и смачивают ее водой (при отсутствии бумажки Синева ее заменяют белой фильтровальной бумажкой, на которую наносят несколько капель 1% спиртового раствора генцианвнолета). Через 1-2 минуты бумажку сбрасывают и на препарат наливают 1-2 капли реактива Люголя. Через 1-2 минуты препарат обесцвечивают 1-2 каплями 96° этилового спирта до появления бледно-серой окраски материала, смывают водой, на 10-15 секунд наносят сруксин Пфейффера, после чего вновь смывают водой и высушивают. В препаратах могут быть обнаружены (рис. 61) стафилококки, стрептококки, диплококки, палочки Пфейффера, спирохеты Плаута-Венсана, актиномицеты и другие микроорганизмы.
Рис. 61. Различные микроорганизмы в мокроте: диплококки (1), палочки Пфейффера (2), стрептококки (3), стафилококки (4), диплобациллы Фридлендера (5), симбиоз Венсана (6), мицелий актиномицет (7).
После проведенного исследования мокроту сжигают или обеззараживают. Последнее достигается следующими способами: а) автоклавированием в течение одного часа при 1,5 атм.; б) кипячением в течение одного часа в 1-2% растворе соды; в) обработкой 5% раствором лизола, карболовой кислоты или смесью, состоящей из равных объемов 5% раствора хлорамина и 5% раствора сернокислого аммония, в течение 12-24 часов. После обеззараживания посуду тщательно моют водой и высушивают.
Металлические предметы (шпатели, иглы) обеззараживают прокаливанием над огнем. Во избежание переноса микроорганизмов из одной порции мокроты в другую шпатель и иглу немедленно прокаливают после отбора соответствующих частиц.
Покровные стекла опускают в небольшую плоскую чашечку с 40% раствором серной кислоты на 12-24 часа. Затем кислоту сливают, а стекла неоднократно промывают водопроводной и дистиллированной водой. Вымытые стекла высушивают и используют для последующих исследований.
источник
Западно-Казахстанский Высший медицинский колледж. Сайт преподавателя МКЛИ Байбулатовой Светланы Андреевны
БАКТЕРИОСКОПИЧЕСКОЕ ИССЛЕДОВАНИЕ МОКРОТЫ.
Это этап исследования мокроты включает микроскопию препаратов, окрашенных по Циль-Нильсену для выявления микобактерий туберкулёза (кислотоустойчивых бактерий, КУБ), препаратов, окрашенных по Граму, для изучения микрофлоры мокроты (стрептококки, стафилококки, пневмококки). В последнем случае бактериоскопическое исследование имеет ориентировочное значение. Правильность выявлений этих бактерий всегда подтверждают посевом.
Техника приготовления окрашенных препаратов.
На край предметного стекла кладутся кусочки из мокроты, растираются другим предметным стеклом до гомогенной массы. Препарат должен занимать не более половины стекла, для удобства при приготовлении, фиксации и окраски. Затем препараты высушивают, фиксируют путём троекратного проведения над пламенем горелки и окрашивают.
Для бактериоскопического исследования готовят обычно два препарата: один для обнаружения микобактерий туберкулёза, другой – для обнаружения прочих микроорганизмов. Для первого препарат отбирают частицы, которые были предназначены для микроскопии, для второго – гнойные частицы.
Первый препарат окрашивают по методу Циль-Нильсену, а второй по Граму.
3. Водный 0,5% р-р метиленовой сини.
1. На препарат кладут квадратик фильтровальной бумаги.
2. Наливают р-р карболового фуксина Циля.
3. Препарат нагревают над пламенем горелки до 3-х кратного отхождения пара.
5. Сбрасывают бумажку и опускают препарат в солянокислый спирт для обесцвечивания.
6. Промывают препарат водой.
7. Докрашивают препарат метиленовым синим в течение 20-30 сек.
8. Промывают водой и высушивают на воздухе.
9. Микроскопируют с иммерсионной системой.
Микобактерии туберкулёза окрашиваются в красный цвет , а все остальные элементы — в синий. Микобактерии имеют вид точек, слегка изогнутых, расположенных группами или поодиночке.
Если микобактерий с мокротой выделяется мало, то в обычных мазках их не находят и прибегают к методу накопления (обогащения).
МЕТОД ОБОГАЩЕНИЯ ПО ПОТТЕНДЖЕРУ.
1. 10-15 мл свежевыделенной мокроты помещают в узкогорлую бутылку.
2. Доливают двойным объёмом 0,5% р-ра NaOH или КОН.
3. Смесь энергично встряхивают 10-15 мин.
4. Добавляют 1 мл летучего вещества (ксилола, толуола, бензола) и 100 мл воды.
5. Снова встряхивают 10-15 мин.
6. Доливают дистиллированной воды до горлышка.
7. Оставляют на один час для отстаивания.
8. Верхний беловатый слой (флотационное кольцо) снимают пипеткой по каплям и наносят на предметные стекла, подогретые на воздушной бане до 60 0 С. Каждую новую каплю наносят на высохшую предыдущую.
10. Красят по Циль-Нильсену.
МЕТОД СЕДИМЕНТАЦИИ МОКРОТЫ.
1. 1 часть мокроты смешивается с 2 частями 10% трёхзамещённого фосфорнокислого натрия ( Na 12 H 2 О).
2. Смесь ставят в термостат на 1 сутки (можно не ставить).
3. Слить надосадочную жидкость.
4. 10 мл надосадочной жидкости центрифугируют при 2000 об/мин в течение 12 мин.
5. Быстро сливают надосадочную жидкость.
6. Из осадка делают препараты, высушивают при Т 90 0 С в течение 30 мин., затем окрашивают по Цилю-Нильсену.
Метод седиментации предпочтительнее, так как при флотации по Поттенджеру образуется аэрозоль, что увеличивает риск заражения мед.персонала.
3. 1% Карболовый раствор генцианового фиолетового.
1. На фиксированный препарат накладывают полоску фильтровальной бумаги.
2. Наносят несколько капель 1% карболового раствора.
3. Через 1-2 мин бумажку сбрасывают и на препарат наливают 1-2 капли реактива Люголя.
4. Через 1-2 мин препарат обесцвечивают 96 0 этиловым спиртом.
5. Препарат промываю водой и докрашивают фуксином Пфейффера 10-15 сек.
6. Промывают водой и высушивают.
7. Микроскопируют с иммерсионной системой.
Грамположительные бактерии окрашивают в фиолетовый цвет (синий), а грамотрицательные – в красный цвет.
В препаратах, окрашенных по Граму, обнаруживают пневмококки, стрептококки, стафилококки, актиномицеты и другие микроорганизмы.
источник
1. На фиксированный препарат помещают полоску фильтровальной бумаги, наливают карболовый фуксин Циля и осторожно нагревают на горелке до появления пара, не допуская кипения жидкости. Нагревание повторяют 3 раза.
2. Снимают бумагу, промывают водой.
3. Погружают 3 раза в 5% раствор серной кислоты.
4. Промывают препарат водой и докрашивают метиленовой синью 5 минут.
5. Промывают водой, высушивают препарат фильтровальной бумагой, микроскопируют.
Контрольные вопросы.
Перечислите и охарактеризуйте основные этапы развития микробиологии. Назовите основные открытия Л. Пастера, Р. Коха, И.И. Мечникова. Заслуги отечественных учёных в развитии микробиологии. Назовите отрасли микробиологии, разделы медицинской микробиологии. Значение микробиологии в работе врача-стоматолога. Положение микроорганизмов среди других живых существ. Перечислите основные группы микроорганизмов. По каким признакам отличаются между собой эукариоты и прокариоты? Основные формы бактерий. Как называется кокки, располагающиеся: попарно, цепочкой, гроздьями, по четыре, пакетами? Как называются палочки, образующие споры? Как называются палочки, не образующие споры? Как называются извитые формы с одним завитком спирали? Как называются извитые формы с несколькими завитками? Методы исследования в микробиологии. Микроскопический метод: что изучает, с помощью чего? Устройство светового микроскопа. Что такое иммерсионная система? Правила работы с иммерсионной системой. Что такое разрешающаяспособность микроскопа и чему она равна у микроскопа с иммерсионной системой? Какова роль иммерсионного масла? Каким свойством должно обладать иммерсионное масло? Куда помещают иммерсионное масло при микроскопии? Нужно ли применять иммерсионное масло при микроскопии с объективом: x8, x40, x90?
Этапы приготовления препарата-мазка. Для чего фиксируют мазок? Способы фиксации мазков. Какие способы окраски называются простыми? Какие красители применяются для окраски бактерий? Какие способы окраски называются сложными, на чём они основаны? Как производится окраска по Граму в модификации Синёва: в какой цвет окрашиваются грамположительные бактерии, почему? В какой цвет окрашиваются грамотрицательные бактерии, почему? Чем обусловлена способность бактерий различно окрашиваться по Граму? Какие бактерии (кокки, палочки, извитые) красятся по Граму положительно и какие отрицательно? Из каких слоёв состоит клеточная стенка грамположительных и грамотрицательных бактерий? Принцип и техника окраски по Цилю-Нильсену. Какие патогенные бактерии являются кислотоустойчивыми?
Работа студента на практическом занятии.
1. Промикроскопируйте демонстрационные мазки — препараты различных форм бактерий: круглые (стафилококк, сарцина, стрептококк), палочковидные (кишечная палочка, стрептобациллы), извитые (вибрионы). К рисункам сделайте подписи: название бактерии, способ окраски, увеличение микроскопа.
2. Заполните в тетради таблицу: «Место микробов среди других живых существ».
3. Опыт окраски по Граму в модификации Синёва.
Цель опыта: определить, имеет ли метод Грама преимущество перед простым методом и в чём оно состоит; определить, в каких случаях целесообразно применение этого метода.
Материалы: стафилококки (грамположительные бактерии) и кишечные палочки (грамотрицательные бактерии).
Ход опыта: приготовить 2 одинаковых мазка из смеси стафилококков и кишечных палочек; один мазок окрасить водным фуксином, другой — по Граму в модификации Синёва. Микроскопировать.
Результат: 2 рисунка и описание их.
Вывод: содержит ответы на вопросы, поставленные в цели опыта.
4. Опыт окраски по Цилю-Нильсену.
Цель опыта: определить имеет ли метод Циля-Нильсена преимущество перед простым методом и в чём оно состоит; определить, в каких случаях целесообразно применение этого метода.
Материалы: 2 одинаковых мазка из смеси туберкулёзной палочки (кислотоустойчивые бактерии) и кишечной палочки (кислотоподатливые бактерии)
Ход опыта: окрасить один мазок простым способом (метиленовой синью), другой — по Цилю-Нильсену. Микроскопировать.
Результат: 2 рисунка и описание их.
Вывод: содержит ответы на вопросы, поставленные в цели опыта.
Методы микроскопического исследования. Структура бактериальной клетки.
Цель самоподготовки.
После самостоятельного изучения материала необходимо знать:
— структуру бактериальной клетки;
— принцип тёмнопольной, фазово-контрастной, люминесцентной и электронной микроскопии.
Исходный уровень знаний.
Для усвоения материала темы необходимо вспомнить:
— принципы классификации микроорганизмов;
— основные размеры и формы бактерий;
— назначение сложных методов окраски.
— устройство и принцип работы тёмнопольного и фазово-контрастного микроскопов;
— устройство и принцип работы люминесцентного микроскопа;
— устройство и принцип работы электронного микроскопа.
Цель занятия.
1. Отметить различия в строении и химическом составе прокариотов и эукариотов.
2.Ознакомиться с основными методами сложной окраски, применяемыми для выявления структурных элементов бактерий.
План изучения темы.
1. Принципы классификации микроорганизмов. Основные формы бактерий и назначение сложных методов окраски (повторить).
2. Постоянные структурные элементы бактериальной клетки.
3. Непостоянные структурные элементы.
4. Биологическая роль структурных элементов бактериальной клетки, методы их выявления.
источник
1) Обработать раствором кислоты и промыть водой
2) Окрасить метиленовым синим и промыть водой
3) Окрасить карболовым фуксином Циля при подогревании
4) Окрасить водным фуксином и промыть водой
5) Окрасить генциановым фиолетовым
Методы окраски позволяющие:
1) дифференцировать бактерии на а) метод Ожешки
две группы по структуре кле- б) метод Грама
точной стенки в) метод Циля-Нильсена
2) выявлять кислотоустойчивые
3) выявлять споры бактерий
Укажите правильный ответ.
Биологическая роль жгутиков бактерий:
3) Сохранение вида в неблагоприятных условиях
Укажите правильный ответ.
Бактерии, имеющие жгутики на обоих полюсах клетки
Укажите правильный ответ.
Бактерии, у которых жгутики расположены по всей поверхности клетки:
Впишите недостающее слово.
Бактерии, имеющие один жгутик — это __________________
Впишите недостающее слово.
Жгутики бактерий состоят из белкового вещества — ____________________
Жгутики бактерий. Способ выявления:
3) Изучение подвижности бактерий
Укажите правильные ответы:
Пили общего типа:
1) Обеспечивают передачу ДНК
3) Обеспечивают прикрепление бактерий к клеткам хозяина
4) Количество пилей у бактерий 100-200
Капсула бактерий — биологическая роль:
3) Сохранение постоянной формы клетки
Капсулообразование у бактерий:
1) пневмококк а) образующие капсулу как в организме
2) палочка перфрингенс так и вне его
3) клебсиеллы пневмонии б) образующие капсулу только в организме
4) клебсиеллы озены человека или животного
Капсула бактерий — способ выявления:
Метод окраски для выявления зерен волютина:
Укажите правильный ответ.
Споры бактерий — биологическая роль:
2) Сохранение вида бактерий в неблагоприятных условиях
Укажите правильный ответ.
Палочки со спорами, диаметр которых не превышает диаметр клетки:
Укажите правильный ответ.
Палочки со спорами, диаметр которых превышает диаметр клетки:
Укажите правильный ответ.
Палочки с терминальным расположением спор:
Укажите вид бактерий, образующих споры:
3) Streptococcus pneumoniae
Укажите ошибки.
Образуют споры:
4) Streptococcus pneumoniae
Укажите условия, способствующие образованию спор:
3) снижение в окружающей среде питательных веществ
5) полноценное питание и влажность
Укажите правильный ответ.
Способ выявления спор у бактерий:
4) Изучение подвижности бактерий
Укажите правильные ответы.
Положение грибов среди живых существ:
4) Бесхлорофильные растения
5) Хлорофилсодержащие растения
Составьте правильное определение из предложенных слов и словосочетаний.
Микроскопические грибы — это:
эукариоты; животные; прокариоты;
низшие растения: содержат хлорофилл;
Структура клеток грибов.
Выберите правильные ответы:
1) Оболочка содержит хитин
2) Оболочка содержит пептидогликан
Укажите правильные ответы.
Относятся к плесневым грибам:
Укажите основное морфологическое отличие дрожжеподобных грибов рода Кандида от дрожжевых грибов:
3) Взаимное расположение клеток
4) Размножение почкованием
Укажите правильные ответы.
Актиномицеты:
Выберите правильные ответы.
Значение актиномицетов в жизни человека:
1) продуценты антибиотиков
В тканях пораженного организма актиномицеты образуют своеобразные морфологические структуры, которые называются
Укажите правильные ответы.
Укажите правильные ответы.
Спирохеты — это:
Структуры, входящие в состав клеток спирохет:
4) цитоплазматическая мембрана
6) двигательный фибриллярный аппарат
8) фибриллы (аналоги жгутиков)
Возбудитель сифилиса — это:
Укажите правильные ответы.
4) Лишены клеточной стенки
Укажите правильные ответы.
4) Внутриклеточные паразиты
Укажите название возбудителя сыпного тифа:
Укажите правильный ответ.
Дата добавления: 2018-09-23 ; просмотров: 83 ; ЗАКАЗАТЬ РАБОТУ
источник
Консультант по гематологии,
цитохимии и микробиологии
Важное место в общем комплексе клинико-лабораторных исследований, применяемых для профилактики, диагностики и лечения гнойно-воспалительных заболеваний и осложнений у больных в лечебно-профилактических учреждениях занимают микробиологические исследования. Современная клиническая медицина предъявляет к микробиологическим (бактериологическим) исследованиям возрастающие требования по увеличению объема, повышению качества исследований, разработке и внедрению новых более совершенных методов. Это связано как с новыми научными достижениями в области эпидемиологии и бактериологии, так и с увеличением гнойно-воспалительных заболеваний, ростом госпитальных инфекций.
Материалом для изучения этиологии заболеваний дыхательных путей служат: отделяемое зева и носа; мокрота; содержимое бронхов, полученное при бронхоскопии или при отсасывании через трахеостому (у больных, находящихся на аппаратном дыхании); экссудаты; резецированные ткани и др. Материал собирают с соблюдением правил асептики в предварительно простерилизованные баночки или пробирки и доставляют в лабораторию. Хранение материала способствует размножению сапрофитирующей микрофлоры, развитию процессов гниения и брожения, что искажает результаты анализа. Интервал между взятием материала и его посевом не должен превышать 1-2 часа. Самым простым методом выявления микобактерий туберкулеза в выделениях больных является микроскопия мазка, приготовленного из мокроты. При бактериоскопии мазка, окрашенного по Цилю-Нильсену, микобактерии туберкулеза могут быть обнаружены при наличии не менее 100 000 — 1 000 000 бактериальных клеток в 1 мл патологического материала (мокроты). Такое большое количество микобактерий встречается у больных с далеко зашедшими прогрессирующими формами заболевания (диссеминированными и фиброзно-кавернозными). У значительно большего числа больных количество выделяемых ими микобактерий ниже предела метода бактериоскопии.
Чувствительность метода люминесцентной микроскопии значительно выше — от 10 000 до 100 000 микобактерий в 1 мл материала, кроме того, этот метод дает возможность за значительно более короткое время просмотреть необходимое количество препаратов. Эффективность бактериоскопии повышается также при передаче изображения на компьютер при помощи присоединенной к микроскопу видеокамеры.
Чтобы диагностировать туберкулез, необходимо сделать все возможное для выявления возбудителя заболевания. Микробиологически диагноз может быть подтвержден на основе результатов культурального исследования на комплекс M. tuberculosis (или, при возможности, путем идентификации специфических последовательностей нуклеиновых кислот) в пробах, взятых в месте локализации патологического процесса. Однако на практике в настоящее время многие лаборатории не располагают материально-технической базой для проведения культуральных исследований. К счастью, микроскопия окрашенных препаратов мокроты доступна практически везде, поэтому диагностика туберкулеза может проводиться на основе выявления кислотоустойчивых микобактерий. На территориях с высокой распространенностью туберкулеза выявление кислотоустойчивых микобактерий в окрашенных препаратах мокроты демонстрирует высокую специфичность, поэтому положительный результат микроскопии мокроты можно рассматривать как подтверждение диагноза. Кроме высокой специфичности к комплексу M. tuberculosis, выявление кислотоустойчивых микобактерий при микроскопии играет важную роль по трем причинам: это – наиболее быстрый метод диагностики туберкулеза; позволяет выявить больных с тяжелым развитием патологии, чреватым высоким риском летального исхода; дает возможность выявить больных, являющихся распространителями инфекции.
Оценка качества работы лабораторий микроскопии должна проводиться соответствующим государственными органом (как правило, представителями национальной программы борьбы с туберкулезом).
Неправильный диагноз, поставленный перед началом лечения, приводит к риску ненужного, неправильного или неудачного лечения. Более того, подобный подход чреват несвоевременной постановкой правильного диагноза и назначением соответствующего лечения. При надлежащем подходе и контроле в большинстве случаев у детей в возрасте пяти лет и старше могут быть получены образцы мокроты. У подростков (хотя они часто относятся к детской возрастной группе, по крайней мере, до 15 лет) получить пробы мокроты не составляет большого труда. Поэтому фактор возраста не может рассматриваться как препятствие для сбора проб мокроты у детей и подростков.
Исходя из имеющихся данных, можно прийти к заключению, что для диагностики туберкулеза необходимо взять не менее двух проб мокроты. В случаях, когда имеются соответствующие возможности, можно направлять для лабораторного исследования еще и третью пробу, но исследование более трех проб мокроты вряд ли целесообразно, поскольку не может в значительной мере повысить эффективность диагностики. Кроме того, исследование третьей пробы может оказаться полезным только для подтверждения диагноза, если одна или две предыдущие пробы дали положительный результат. Крайне желательно, чтобы результаты микроскопии мокроты направлялись лечащему врачу в течение одного рабочего дня с момента отправки проб. Не меньшее значение имеет также и время сбора проб. Результаты исследований показывают, что эффективность лабораторных анализов максимальна, если пробы мокроты получены утром, после пробуждения от ночного сна. Возможно, совершенно необязательно собирать только утренние пробы, но, про крайней мере, одна из них должна быть получена утром.
Как правило, внелегочные очаги туберкулезного процесса содержат гораздо меньшее количество M. tuberculosis, поэтому микроскопическое выявление кислотоустойчивых микобактерий в пробах из внелегочных очагов весьма затруднено, и в таких случаях результаты культуральных исследований приобретают большое значение. Учитывая низкую результативность микроскопии, при внелегочном туберкулезе культуральные и морфологические исследования приобретают особое значение, например, в диагностическом исследовании проб ткани лимфатических узлов, полученных при помощи игловой биопсии.
Лечение пациентов, у которых наблюдаются тяжелое или быстро развивающееся заболевания, ассоциированные с туберкулезом, необходимо начинать немедленно, даже до лабораторного подтверждения диагноза. Лечение следует начинать до получения результатов лабораторного исследования и лишь позднее внести необходимые поправки и изменения в схему лечения с учетом результатов микроскопии.
Хотя микроскопия мокроты является наиболее доступным бактериологическим тестом, там, где ресурсы позволяют и имеются условия для качественной лабораторной диагностики, в диагностический алгоритм необходимо включать культуральные исследования мокроты, в случаях отрицательных результатов микроскопии. Правильное проведение культуральных исследований связано с определенными трудностями и дополнительными затратами, но этот метод отличается более высокой чувствительностью и повышает вероятность раннего выявления больных туберкулезом.
Микроскопия мазков мокроты по Циль-Нильсену является важнейшим элементом диагностики туберкулеза. Исследование 3 мазков мокроты позволяет выявить более 60% случаев туберкулеза легких и 95% наиболее заразных случаев (исследование одного мазка мокроты выявляет 75% наиболее заразных случаев, исследование второго мазка мокроты добавляет еще 20%, а исследование третьего — еще 5%).
Микроскопия мазков мокроты по Циль-Нильсену позволяет быстро получить результаты, выявить основные источники инфекции, является менее дорогостоящей, чем посев мокроты и широко доступна для применения. Но она должна быть надежной и хорошо контролироваться. Вероятность обнаружения МБТ при бактериоскопии мазков мокроты прямо пропорциональна концентрации возбудителя в исследуемом материале. Например, когда в 1 мл мокроты содержится от 1000 до 10000 МБТ, то вероятность получения положительного результата составляет около 40-50%. При концентрации МБТ менее 1000 в 1 мл мокроты вероятность их обнаружения резко снижается – отрицательные результаты получаются примерно в 96% случаев.
Основным и наиболее часто изучаемым биоматериалом в пульмонологической практике является мокрота. Требования к забору и качеству мокроты следующие:
1) первую пробу мокроты желательно получить до начала курса антибиотикотерапии;
2) мокроту оптимально собирать утром, до приема пищи, после тщательного туалета полости рта (полоскание кипяченой водой);
3) больным нужно доступно объяснить, что требуется получить именно содержимое нижних отделов дыхательных путей, а не ротоглотки, и, по возможности, проконтролировать их действия;
4) забор материала проводить в стерильные интактные контейнеры;
5) продолжительность хранения мокроты в контейнерах не должна превышать 2 ч (в летнее время желательно не более 1 ч);
6) в условиях лаборатории качество мокроты оценивается после окрашивания мазка по Граму (при наличии в мазке менее 25 лейкоцитов и более 10 эпителиальных клеток, при просмотре не менее 8-10 полей зрения при малом увеличении, мокрота признается некачественной, дальнейшее ее исследование нецелесообразно, так как, скорее всего, материал получен из ротовой полости);
7) высокая диагностическая ценность исследования признается при выделении возбудителя в концентрации і106 КОЕ/мл.
Вообще, в диагностике заболеваний туберкулезом можно выделить несколько этапов:
· Преаналитический этап (предварительный диагноз, выбор материала и метода исследования, забор биомтериала и его транспортировка)
· Аналитический этап (непосредственно проведение анализа)
· Постаналитический этап (оценка результатов)
Часть этих этапов проводится вне лаборатории, поэтому очень важна согласованная и качественная работа всех специалистов, привлеченных в этот процесс. Важен правильный выбор исследуемого материала. Важным этапом диагностики являются процедуры взятия и доставки материала в лабораторию.При взятии всех видов исследуемого материала следует ориентироваться на стандартные системы для этой цели: тампоны, цитощетки, тубсеры, контейнеры и т.п. Эффективность аналитического этапа во многом определяется уровнем технического оснащения лабораторий. Постаналитический этап исследования включает две составляющие: проверку достоверности полученного результата и оценку этиологической значимости выделенных штаммов. В лаборатории должен осуществляться строгий внутренний контроль качества исследований, важной составляющей которого является проверка полученных результатов на достоверность. Оценка этиологической значимости выделенных микроорганизмов принципиальна для выбора адекватной терапии. Процедура приготовления мазков начинается с подготовки предметных стекол. Необходимо использовать только новые, отмытые и обезжиренные в спирте или смеси для обезжиривания предметных стекол (производство АБРИС+) стекла без царапин и сколов. При повторном использовании стекла могут быть недостаточно хорошо отмыты от предыдущего материала, что может привести к получению ложноположительных результатов. Не рекомендуется использовать саморезанные стекла, которые приводят к значительным аберрациям исследуемого изображения. Стекла должны соответствовать ГОСТу. Стекла, на которых при микроскопическом исследовании были обнаружены кислотоустойчивые микобактерии, сохраняются в лаборатории в течение 1 года, а затем подлежат обязательному уничтожению и не должны использоваться повторно. Новые предметные стекла кипятят 15 минут в 1% растворе питьевой соды (10 г двууглекислого натрия на 1 л воды), промывают в 1% растворе соляной кислоты (к 1 л воды добавляют 10 мл концентрированной соляной кислоты), а затем промывают в проточной воде и протирают насухо.
Для обезжиривания вымытые и высушенные стекла помещают в герметически закрытые емкости со смесью для обезжиривания. Стекла должны подвергаться обезжириванию в течение суток. Непосредственно перед приготовлением мазков стекла повторно протираются насухо. Для окраски мазков, приготовленных непосредственно из диагностического материала (метод прямой микроскопии), наиболее часто используется метод Ziehl-Neelsen (Циль-Нильсен) (Реагенты — «Диахим» — набор для окраски по Циль-Нильсену»)..
источник
Микобактериозы – группа инфекционных заболеваний человека и животных, включая все виды птиц, вызываемая бактериями рода Mycobacterium.
Большинство видов микобактерий
птиц вызывают хроническую (зачастую без проявления внешней симптоматики в течение длительного периода времени) полиорганную инфекцию с поражением печени, селезенки, легких, кишечника, суставной и костной ткани.
Также процесс может протекать локально, с поражением отдельных участков кожи и прилежащих тканей (чаще в области головы либо конечностей).
Некоторые виды возбудителя являются зооантропонозными, т.е.заразны для животных и человека. К ним относятся в том числе Mycobacterium tuberculosis, M.bovis и M.avium, вызывающие у людей туберкулёз. Передача возбудителя может происходить от птицы человеку и наоборот – в равной степени и люди, болеющие туберкулёзом, несут опасность заражения для домашних птиц, проживающих с ними.
Помимо трех вышеобозначенных видов, есть и другие микобактерии (M.fortuitum, M. scrofulaceum, M. intracellulare и др.), встречающиеся у птиц и потенциально опасные для людей. Чаще они не вызывают системных поражений (тубёркулеза), однако могут провоцировать очаговые хронические дерматиты с образованием абсцессов; главным образом, к группе риска по подобным атипичным микобактериозам относятся дети младшего возраста, пожилые люди, ВИЧ-положительные, онко-больные, а также люди, проходящие химиотерапию или иммуносупрессивную терапию.
Проблема постановки диагноза на микобактериоз и лабораторной диагностики данного заболевания у птиц стоит весьма остро, и на то есть несколько причин:
1. неравномерное выделение возбудителя из организма больного животного – не каждая проба помета может нести в себе микобактерии или содержать достаточное их количество для диагностики. Отсюда вытекает две сопутствующие проблемы:
1.1 необходимость проведения серий анализов – окраска по Цилю-Нильсену, ПЦР, посевы на питательные среды– для постановки окончательного диагноза;
1.2 зачастую требуется концентрация микобактерий в материале (методом флотации) перед проведением анализа, что в разы повышает эффективность обнаружения возбудителя при любом методе диагностики (окраске, ПЦР, посевах).
Микроскопия окрашенной по методу Циля-Нильсена мокроты человека, больного туберкулезом: справа на фото материал после концентрации (источник: статья «Методы окраски микроорганизмов» probakterii.ru)
2. необходимость концентрации материала приводит к последующей сложности: соответствующее оснащение лабораторий для безопасной работы с концентрированным зооантропонозным возбудителем в материале для проведения анализов. Именно за счёт повышенного риска для сотрудников при работе с концентрированными пробами единицы лабораторий (как правило, это государственные лаборатории на базе НИИ) ведут данную деятельность.
[немаловажно: риск заражения владельца прямо пропорционален длительности его проживания с зараженной птицей, т.к.птица-бактериовыделитель способствует поддержанию высокой, нарастающей концентрации микобактерий в помещении, особенно при отсутствии регулярной уборки со специфическими дез.средствами, т.к.микобактерии являются кислото-, спирто-, щёлоче-устойчивыми микроорганизмами, длительно сохраняющимися в окружающей среде]Выдержка из статьи «Туберкулез – профессиональное заболевание у медицинских работников» В.В.Косарев, С.А.Бабанов: «По степени риска заражения туберкулезом медицинские работники распределяются следующим образом: на первом месте — персонал бактериологических лабораторий (контакт с больными туберкулезом и живой патогенной культурой); затем — работники стационаров противотуберкулезных учреждений (контакт с больными с лекарственной устойчивостью микобактерий, что подтверждает внутрибольничный путь заражения); … распространенность латентной туберкулезной инфекции крайне высока среди медицинских работников (31,3 %), в особенности среди сотрудников противотуберкулезной службы (49,3 %)…»
Для диагностики микобактериозов у содержащихся в неволе птиц в России доступны следующие методы:
Материал: помет, мокрота, мазки со слизистых оболочек и из очагов поражения кожи, синовиальная и перитонеальная жидкость, мазки-отпечатки органов при посмертной диагностике.
Принцип метода основан на обнаружении микобактерий при микроскопии материала – в готовом мазке они окрашены в красный цвет красителем фуксином Циля, т.к.являются кислотоустойчивыми, большинство же других микроорганизмов обесцвечивается (на этапе промывания мазка серной кислотой после фуксина) и затем окрашивается в синий (на этапе завершающей окраски метиленовой синью).
| Преимущества: | Недостатки: | ||||||||||||
|
Окрашенные по методу Циля-Нильсена помёт жако – слева (более 40 микобактерий в поле зрения микроскопа), помёт сизого голубя – по центру (единичные микобактерии в поле зрения), помёт кореллы – справа (более 100 микобактерий в поле зрения). Фото автора. При последующей сдаче помёта от данных пациентов на ПЦР-диагностику только от жако с первого же раза была получена положительная ПЦР и подтвержден возбудитель M.bovis. Две другие птицы прореагировали ложно-отрицательно. Корелла прореагировала положительно при повторной ПЦР по помёту. Голубь прореагировал ложно-отрицательно при повторной ПЦР по помёту, но диагноз был подтвержден по ПЦР крови. Материал: кровь, помет, мокрота, мазки со слизистых оболочек и из очагов поражения кожи, синовиальная и перитонеальная жидкость, кусочки органов при посмертной диагностике.
Материал: помет, мокрота, мазки со слизистых оболочек и из очагов поражения кожи, синовиальная и перитонеальная жидкость, кусочки органов при посмертной диагностике. Метод основан на культивировании (высевании) бактерий из материала на специальных питательных средах (наиболее часто используемой является среда Левенштейна-Йенсена), с целью обнаружения роста возбудителя и дальнейшего получения чистой культуры микобактерий для проведения последующей типизации.
|