Нормальные показатели: белок в норме в моче содержится в минимальных количествах, которые не обнаруживаются обычными качественными реакциями. Верхняя граница нормы белка в моче – 0,033 г/л. Если содержание белка выше этого значения, то качественные пробы на белок становятся положительными.
Клиническое значение определения:
Появление белка в моче называется протеинурия. Протеинурии могут быть ложными и почечными. Экстраренальные протеинурии могут быть при наличии примесей белкового происхождения из половых органов (вагинитах, уретритах и др.), количество белка при этом незначительно – до 0,01 г/л. Почечные протеинурии могут быть функциональными (при переохлаждении, физических нагрузках, лихорадке) и органическими — при гломерулонефрите, пиелонефрите, нефрите, нефрозах, почечной недостаточности. При почечных протеинуриях содержание белка может быть от 0,033 до 10 – 15 г/л, иногда выше.
Принцип метода: основан на том, что белок под действием неорганических кислот коагулирует (становится видимым). Степень помутнения зависит от количества белка.
Обнаружение белка в моче с 20% сульфосалициловой кислотой.
Реактивы: 20% р-р сульфосалициловой кислоты. Оборудование: темный фон.
1. Требования к моче: моча должна быть кислой (или слабокислой) рН, должна быть прозрачной, для этого мочу центрифугируют. Щелочную мочу подкисляют до слабокислой реакции среды, используя для контроля индикаторную бумагу.
2. В 2 пробирки одинакового диаметра наливают по 2 мл подготовленной мочи. 1 пробирка – контроль, 2 – опыт. В опытную пробирку добавляют 4 капли 20% сульфосалициловой кислоты.
3. Результат отмечают на темном фоне.
4. При наличии белка, моча в опытной пробирке мутнеет.
Качественное определение белка в моче тест – полосками.
Для выявления протеинурий используют различные монотест – полоски: Альбуфан, Альбустикс, Биофан Е и политесты: Трискан, Нонафан и др.
Обнаружение белка в моче по методу Робертса – Стольникова.
Принцип метода: основан на том, что белок под действием неорганических кислот коагулирует (становится видимым). Степень помутнения зависит от количества белка (т.е. кольцевая проба Геллера). При концентрации белка в моче 0,033 г/л к концу 3 минуты после наслаивания мочи появляется тонкое нитевидное белое кольцо.
Реактивы: 50% р-р азотной кислоты или реактив Робертса (98 частей насыщенного раствора поваренной соли и 2 части концентрированной соляной кислоты) или реактив Ларионовой (98 частей насыщенного р-ра поваренной соли и 2 части концентрированной азотной кислоты).
1. 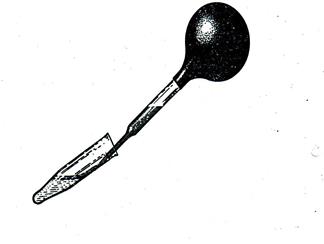
2. В пробирку наливают 2 мл 50% р-ра азотной кислоты или один из реактивов, затем осторожно по стенке пробирки с помощью пипетки наслаивают такой же объем подготовленной мочи
3. Пробу оставляют на 3 минуты
4. Через 3 минуты отчитывают результат. Результат отмечают на темном фоне в проходящем свете. Если кольцо широкое, компактное, то мочу разводят дистиллированной водой и вновь наслаивают на реактив.
5. Мочу разводят до тех пор, пока через 3 минуты не образуется тонкое нитевидное кольцо.
6. Расчет содержания белка в моче производят по формуле:
С = 0,033г/л х степень разведения.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Да какие ж вы математики, если запаролиться нормально не можете. 8380 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Патологическая протеинурия является одним из наиболее важных и постоянных признаков заболеваний почек и мочевых путей. Определение концентрации белка в моче является обязательным и важным элементом исследования мочи. Выявление и количественная оценка протеинурии важна не только в диагностике многих первичных и вторичных заболеваний почек, оценка изменения выраженности протеинурии в динамике несет информацию о течении патологического процесса, об эффективности проводимого лечения. Обнаружение белка в моче даже в следовых количествах должно настораживать в отношении возможного заболевания почек или мочевых путей и требует повторного анализа. Особо следует отметить бессмысленность исследования мочи и, в частности, определения белка мочи без соблюдения всех правил ее сбора.
Все методы определения белка в моче можно разделить на:
- Качественные,
- Полуколичественные,
- Количественные.
Все качественные пробы на белок в моче основаны на способности белков к денатурации под влиянием различных физических и химических факторов. При наличии белка в исследуемом образце мочи появляется либо помутнение, либо выпадение хлопьевидного осадка.
Условия определения белка в моче на основе реакции коагуляции:
- Моча должна иметь кислую реакцию. Мочу щелочной реакции подкисляют несколькими (2 — 3) каплями уксусной кислоты (5 – 10%).
- Моча должна быть прозрачной. Помутнение устраняется через бумажный фильтр. Если помутнение не исчезает, добавляют тальк или жженую магнезию (около 1 чайной ложки на 100 мл мочи), взбалтывают и фильтруют.
- Качественную пробу следует проводить в двух пробирках, одна из них – контрольная.
- Искать помутнение следует на черном фоне в проходящем свете.
К качественным методам определения белка в моче относятся:
Как показывают многочисленные исследования, ни один из большого числа известных методов качественного определения белка в моче не позволяет получать надежные и воспроизводимые результаты. Несмотря на это, в большинстве КДЛ в России эти методы широко используются в качестве скрининга – в моче с положительной качественной реакцией в дальнейшем проводят количественное определение белка. Из качественных реакций чаще используют пробу Геллера и пробу с сульфосалициловой кислотой, однако пробу с сульфосалициловой кислотой большей частью считают наиболее подходящей для выявления патологической протеинурии. Проба с кипячением в настоящее время практически не используется в связи с ее трудоемкостью и длительностью.
В основе метода Брандберга-Робертса-Стольникова лежит кольцевая проба Геллера, поэтому при данном методе наблюдаются те же ошибки, что и при пробе Геллера.
В настоящее время для определения белка в моче все чаще используются диагностические полоски. Для полуколичественного определения белка в моче на полоске в качестве индикатора чаще всего используется краситель бромфеноловый синий в цитратном буфере. О содержании белка в моче судят по интенсивности сине-зеленой окраски, развивающейся после контакта реакционной зоны с мочой. Результат оценивается визуально или с помощью анализаторов мочи. Несмотря на большую популярность и очевидные преимущества методов сухой химии (простота, скорость выполнения анализа) данные методы анализа мочи в целом и определения белка в частности не лишены серьезных недостатков. Одним из них, приводящих к искажению диагностической информации, является большая чувствительность индикатора бромфенолового синего к альбумину по сравнению с другими белками. В связи с этим, тест-полоски в основном приспособлены к обнаружению селективной гломерулярной протеинурии, когда практически весь белок мочи представлен альбумином. При прогрессировании изменений и переходе селективной гломерулярной протеинурии в неселективную (появление в моче глобулинов) результаты определения белка оказываются заниженными по сравнению с истинными значениями. Данный факт не дает возможности использовать данный метод определения белка в моче для оценки состояния почек (гломерулярного фильтра) в динамике. При тубулярной протеинурии результаты определения белка также оказываются заниженными. Определение белка с помощью диагностических полосок не является надежным индикатором низких уровней протеинурии (большинство выпускаемых в настоящее время диагностических полосок не обладают способностью улавливать белок в моче в концентрации ниже, чем 0,15 г/л). Отрицательные результаты определения белка на полосках не исключают присутствия в моче глобулинов, гемоглобина, уромукоида, белка Бенс-Джонса и других парапротеинов.
Хлопья слизи с высоким содержанием гликопротеидов (например, при воспалительных процессах в мочевых путях, пиурии, бактериурии) могут оседать на индикаторной зоне полоски и приводить к ложноположительным результатам. Ложноположительные результаты могут также быть связаны с высокой концентрацией мочевины. Плохое освещение и нарушение цветоощущения может быть причиной неточного результата.
В связи с этим, использование диагностических полосок следует ограничить скринирующими процедурами, а результаты, полученные с их помощью, следует рассматривать лишь как ориентировочные.
Корректное количественное определение белка в моче в ряде случаев оказывается непростой задачей. Трудности ее решения определяются следующим рядом факторов:
- низким содержанием белка в моче здорового человека, часто находящимся на пороге чувствительности большинства известных методов;
- присутствием в моче множества соединений, способных вмешиваться в ход химических реакций;
- значительными колебаниями содержания и состава белков мочи при различных заболеваниях, затрудняющими выбор адекватного калибровочного материала.
В клинических лабораториях преимущественно применяются так называемые «рутинные» методы определения белка в моче, однако они далеко не всегда позволяют получать удовлетворительные результаты.
С точки зрения специалиста-аналитика, работающего в лаборатории, метод, предназначенный для количественного определения белка в моче, должен отвечать следующим требованиям:
- обладать линейной зависимостью между поглощением образовавшегося в ходе химической реакции комплекса и содержанием белка в пробе в широком диапазоне концентраций, что позволит избежать дополнительных операций при подготовке пробы к исследованию;
- должен быть прост, не требовать высокой квалификации исполнителя, выполняться при малом количестве операций;
- обладать высокой чувствительностью, аналитической надежностью при использовании небольших объемов исследуемого материала;
- быть устойчивым к воздействию различных факторов (колебаниям состава образца, присутствию лекарственных препаратов и др.);
- обладать приемлемой стоимостью;
- быть легко адаптируемым к автоанализаторам;
- результат определения не должен зависеть от белкового состава исследуемого образца мочи.
Ни один из известных к настоящему времени методов количественного определения белка в моче не может в полной мере претендовать на роль «золотого стандарта».
Количественные методы определения белка в моче можно разделить на турбидиметрические и колориметрические.
К турбидиметрическим методам относятся:
- определение белка с сульфосалициловой кислотой (ССК),
- определение белка с трихлоруксусной кислотой (ТХУ),
- определение белка с бензетоний хлоридом.
Турбидиметрические методы основаны на снижении растворимости белков мочи вследствие образования суспензии взвешенных частиц под воздействием преципитирующих агентов. О содержании белка в исследуемой пробе судят либо по интенсивности светорассеяния, определяемого числом светорассеивающих частиц (нефелометрический метод анализа), либо по ослаблению светового потока образовавшейся суспензией (турбидиметрический метод анализа).
Величина светорассеяния в преципитационных методах обнаружения белка в моче зависит от множества факторов: скорости смешивания реактивов, температуры реакционной смеси, значения pH среды, присутствия посторонних соединений, способов фотометрии. Тщательное соблюдение условий реакции способствует образованию стабильной суспензии с постоянным размером взвешенных частиц и получению относительно воспроизводимых результатов.
Некоторые лекарственные препараты влияют на результаты турбидиметрических методов определения белка в моче, приводя к так называемым «ложноположительным», либо «ложноотрицательным» результатам. К ним относятся некоторые антибиотики (бензилпенициллин, клоксациллин и др.), рентгеноконтрастирующие йодсодержащие вещества, сульфаниламидные препараты.
Турбидиметрические методы плохо поддаются стандартизации, часто приводят к получению ошибочных результатов, но, несмотря на это, в настоящее время они широко используются в лабораториях из-за невысокой стоимости и доступности реактивов. Наиболее широко в России используется метод определения белка с сульфосалициловой кислотой.
Наиболее чувствительными и точными являются колориметрические методы определения общего белка мочи, основанные на специфических цветных реакциях белков.
- биуретовая реакция,
- метод Лоури,
- методы, основанные на способности различных красителей образовывать комплексы с белками:
- Понсо S (Ponceau S),
- Кумасси бриллиантовый синий (Coomassie Brilliant Blue)
- пирогаллоловый красный (Pyrogallol Red).
С точки зрения исполнителя, в повседневной работе лаборатории при большом потоке исследований биуретовый метод является неудобным из-за большого числа операций. В то же время, метод характеризуется высокой аналитической надежностью, позволяет определять белок в широком диапазоне концентраций и выявлять альбумин, глобулины и парапротеины со сравнимой чувствительностью, вследствие чего биуретовый метод рассматривают в качестве референтного и рекомендуют для сравнения других аналитических методов обнаружения белка в моче. Биуретовый метод определения белка в моче предпочтительно выполнять в лабораториях, обслуживающих нефрологические отделения, и использовать в тех случаях, когда результаты определения с помощью других методов представляются сомнительными, а также для определения величины суточной потери белка у нефрологических больных.
Метод Лоури, обладающий более высокой чувствительностью по сравнению с биуретовым методом, сочетает биуретовую реакцию и реакцию Фолина на аминокислоты тирозин и триптофан в составе белковой молекулы. Несмотря на высокую чувствительность, данный метод не всегда обеспечивает получение надежных результатов при определении содержания белка в моче. Причиной тому служит неспецифическое взаимодействие реактива Фолина с небелковыми компонентами мочи (чаще всего аминокислотами, мочевой кислотой, углеводами). Отделение этих и других компонентов мочи путем диализа или осаждения белков позволяет с успехом использовать данный метод для количественного определения белка в моче. Некоторые лекарственные препараты – салицилаты, хлорпромазин, тетрациклины способны оказывать влияние на данный метод и извращать результаты исследования.
Достаточная чувствительность, хорошая воспроизводимость и простота определения белка по связыванию красителей делают эти методы перспективными, однако высокая стоимость реактивов препятствует более широкому их использованию в лабораториях. В настоящее время в России все большее распространение получает метод с пирогаллоловым красным.
Проводя исследование уровня протеинурии, нужно иметь ввиду, что различные методы определения протеинурии имеют разную чувствительность и специфичность к многочисленным белкам мочи.
Исходя из эмпирических данных, рекомендуется определять белок двумя разными методами и рассчитывать истинное значение по одной из приведенных формул:
протеинурия = 0,4799 B + 0,5230 L;
протеинурия = 1,5484 B – 0,4825 S;
протеинурия = 0,2167 S + 0,7579 L;
протеинурия = 1,0748 P – 0,0986 B;
протеинурия = 1,0104 P – 0,0289 S;
протеинурия = 0,8959 P + 0,0845 L;
где:
B – результат измерения с Кумасси G-250;
L — результат измерения с реактивом Лоури;
P — результат измерения с молибдатом пирогаллола;
S — результат измерения с сульфосалициловой кислотой.
Учитывая выраженные колебания уровня протеинурии в различное время суток, а также зависимость концентрации белка в моче от диуреза, различное его содержание в отдельных порциях мочи, в настоящее время при патологии почек принято оценивать выраженность протеинурии по суточной потере белка с мочой, то есть определять так называемую суточную протеинурию. Она выражается в г/сут.
При невозможности сбора суточной мочи рекомендуется определять в разовой порции мочи концентрации белка и креатинина. Поскольку скорость выделения креатинина в течение дня достаточно постоянна и не зависит от изменения скорости мочеотделения, отношение концентрации белка к концентрации креатинина постоянно. Данное отношение хорошо коррелирует с суточной экскрецией белка и, следовательно, может использоваться для оценки выраженности протеинурии. В норме отношение белок/креатинин должно быть менее 0,2. Белок и креатинин измеряют в г/л. Важным достоинством метода оценки выраженности протеинурии по соотношению белок-креатинин является полное исключение ошибок, связанных с невозможностью или неполным сбором суточной мочи.
- О. В. Новоселова, М. Б. Пятигорская, Ю. Е. Михайлов, «Клинические аспекты выявления и оценки протеинурии», Справочник заведующего КДЛ, № 1, январь 2007 г.
- А. В. Козлов, «Протеинурия: методы ее выявления», лекция, Санкт-Петербург, СПбМАПО, 2000 г.
- В. Л. Эмануэль, «Лабораторная диагностика заболеваний почек. Мочевой синдром», — Справочник заведующего КДЛ, № 12, декабрь 2006 г.
- В.И. Пупкова, Л.М. Прасолова — Определение белка в моче и спинномозговой жидкости. Кольцово, 2007 г.
- Справочник по клиническим лабораторным методам исследования. Под ред. Е. А. Кост. Москва, «Медицина», 1975 г.
Для количественного определения белка пригоден любой образец мочи. Большинство исследователей для выяснения величины суточной потери белка предпочитают определять содержание белка в моче, собранной за сутки.
Раздел: Анализ мочи
В настоящее время для определения белка в моче все чаще используются диагностические полоски. Для полуколичественного определения белка в моче на полоске в качестве индикатора чаще всего используется краситель бромфеноловый синий в цитратном буфере. О содержании белка в моче судят по интенсивности сине-зеленой окраски, развивающейся после контакта реакционной зоны с мочой.
Раздел: Анализ мочи
Все качественные пробы на белок в моче основаны на способности белков к денатурации под влиянием различных физических и химических факторов. При наличии белка в исследуемом образце мочи появляется либо помутнение, либо выпадение хлопьевидного осадка.
Раздел: Анализ мочи
Проба с 20% сульфосалициловой кислотой относится к качественным реакциям определения белка в моче. Так как она основана на реакции коагуляции, то исследуемая моча должна соответствовать определенным требованиям: быть прозрачной и иметь кислую реакцию.
Раздел: Анализ мочи
Кольцевая проба Геллера относится к качественным реакциям определения белка в моче. Так как она основана на реакции коагуляции, то исследуемая моча должна соответствовать определенным требованиям: быть прозрачной и иметь кислую реакцию.
Раздел: Анализ мочи
источник
Белки представляют собой сложные высокомолекулярные структуры, которые играют важнейшую роль в процессе клеточной жизнедеятельности и принимают участие во всех происходящих в организме человека процессах. Однако появление в анализе мочи белка нормой не считается, по крайней мере, далеко не во всех случаях. Напротив, данное явление может быть свидетельством каких-либо нарушений и требует назначения дальнейших исследований.
Обычно общий анализ мочи на белок назначается в следующих случаях:
- в качестве одного из исследований во время профилактических осмотров;
- при болезнях системы мочеотделения;
- для оценки эффективности проводимой терапии, развития возможных осложнений и анализа динамики заболевания (например, при почечной недостаточности или сахарном диабете);
- при подозрении на наличие белка и эритроцитов в моче;
- через одну или две недели после перенесенной стрептококковой инфекции.
Анализ позволяет выявить признаки патологии почек, но вместе с тем может иметь и более широкое диагностическое значение. При этом спектр вероятных заболеваний при обнаружении белка в моче довольно велик.
Для максимально точной и достоверной диагностики при исследовании должен использоваться суточный анализ мочи на белок. Особенно это важно, если анализ проводится с целью оценки функции почек. Моча пациента собирается в течение 24 часов в специальный контейнер, при этом первая утренняя моча не сохраняется. В процессе сбора материала для анализа контейнер должен храниться в прохладном месте. Но нередко вместо суточного анализа мочи врачи используют метод определения белка в разовой порции мочи с помощью электрофореза.
Перед сбором мочи для анализа необходимо подмыться. Для получения объективных результатов незадолго перед исследованием важно воздержаться от приема лекарственных препаратов. Такие медикаменты, как сульфонамиды, оксациллин, салицилаты, толбутамид, пенициллин, цефалоспорины и аминогликозиды могут особенно сильно исказить результаты общего анализа мочи на белок.
Чтобы врач смог правильно определить содержание белка в составе мочи, желательно перед исследованием воздержаться от чрезмерных физических нагрузок. Такие факторы, как недавно перенесенные инфекционные заболевания, повышенная температура тела или наличие инфекций мочевыводящих путей могут значительно повлиять на результаты анализов, поэтому перед исследованием важно известить врача о подобных обстоятельствах или особенностях самочувствия.
Считается, что в норме белок не должен присутствовать в моче совсем. Однако у здорового человека может наблюдаться незначительное содержание белка, не связанное с какими-либо нарушениями или заболеваниями. Допустимая концентрация белка должна быть не более 0,033 г/л. В случае сдачи суточного анализамочи на белоксредний показатель нормального содержания белка составляет не более 150 мг в сутки.
Состояние, при котором норма белка в моче превышена, называется протеинурией. Протеинурия в легкой форме не имеет какой-либо симптоматики, однако со временем она может перейти в более тяжелую стадию.
Форма протеинурии обычно может быть легко определена с помощью суточного анализа мочи на белок:
- содержание белка в суточной дозе мочи в пределах 30–300 мг – наиболее мягкая и незаметно протекающая форма протеинурии;
- от 300 мг до 1 г в сутки – легкая форма протеинурии;
- от 1 г до 3 г в сутки – умеренная форма протеинурии;
- более 3 г в сутки – тяжелая (выраженная) форма протеинурии.
Симптомы, которые возникают при длительном превышении концентрации белка в анализе мочи, могут быть следующими:
- быстро прогрессирующая утомляемость;
- сонливость и головокружение;
- повышение температуры, озноб (в случае воспалительных процессов);
- потеря аппетита, тошнота и рвота;
- изменение цвета мочи – в зависимости от вида присутствующих в ней белков она может приобрести красноватую или белесоватую окраску;
- изменение структуры мочи – она становится пенистой;
- отечность лица, ног и рук;
- нефропатия, при которой молекулы белка откладываются в пальцах рук или ног.
Основной причиной высокой концентрации белка в моче является нарушение работы почек, но это далеко не единственный возможный диагноз. Иногда причины повышенного содержания белка в моче могут быть очевидными.
Например, концентрация белка может увеличиться при наличии достаточно серьезных ожогов или длительном приеме некоторых препаратов. Но для постановки точного и достоверного диагноза обязательно назначаются дополнительные исследования, так как высокий белок может быть признаком целого ряда заболеваний и нарушений:
- множественной миеломы;
- заболеваний соединительной ткани (системной красной волчанки, выражающейся в виде гломерулонефрита или волчаночного нефрита);
- сахарного диабета;
- длительного переохлаждения;
- длительной или быстро прогрессирующей артериальной гипертензии;
- инфекционных или воспалительных процессов в почках;
- механических повреждений почки;
- злокачественных новообразований в почках;
- хронической сердечной недостаточности.
- токсических отравлений.
источник
Белок в моче у ребенка свидетельствует о том, что почки работают не так, как следует. Иногда инфекция или химические вещества повреждают почки, что становится причиной появления белка в моче.
Протеинурия не сопровождается болями, но при ней уровень белка в крови может понизиться. Это приводит к отеку лодыжек и ног. Еще одним признаком этой проблемы является высокое кровяное давление.
Стойкая протеинурия является индикатором гломерулярного поражения. Она также может играть центральную роль в прогрессировании клубочковых поражений на поздних стадиях хронического заболевания почек. Поэтому некоторые считают протеинурию нефротоксичной. В настоящее время консенсус заключается в том, что уменьшение степени протеинурии является императивом ренопротекторной терапии. Целью фармакотерапии является смягчение гломерулярной гиперфильтрации с использованием ингибиторов ангиотензинпревращающего фермента или блокаторов рецепторов ангиотензина.
Наличие белка в моче обычно указывает на изменение проницаемости и селективных свойств совокупного клубочкового фильтрующего барьера, который охватывает 3 основных компонента стенки клубочковой капилляра, щелевые диафрагмы между:
- смежными процессами эпителиальных клеток;
- клубочковой базальной мембраны;
- слоя фенетрированных эндотелиальных клеток.
До недавнего времени фиксированный отрицательный электростатический заряд сиалопротеинового покрытия эпителиального слоя стопы и базальной мембраны клубочков считался важным детерминантом селективности фильтрационного барьера, ограничивающим доставку сывороточного альбумина в клубочковый фильтрат при отсутствии заболевания. Однако последние исследования указывают на то, что молекулярный размер, а не электростатический заряд, является ключевым фактором, ограничивающим прохождение белка через фильтрующий барьер, фильтрующий барьер находится в комплексной ситовой функции многочисленных белков, включающих щелевые поры между межузельными ступнями соседних эпителиальных клеток.
Хотя эта дискуссия сосредоточена на случайном обнаружении патологической протеинурии у здорового пациента, моча всегда должна тестироваться на протеины у любого с обнаружением:
- гематурии;
- отека;
- гипертонии;
- азотемии;
- аномальной визуализацией почек и мочевыводящих путей.
Положительная реакция на белок, связанная с брутто-гематурией, зависит от альбумина плазмы, который сопровождает эритроциты в моче.
Ортостатическая протеинурия встречается у некоторых детей постарше и в подростковом возрасте. Это доброкачественное состояние без клинического значения. Слово «ортостатик» означает «вертикально». Термин «ортостатическая протеинурия» появился, потому что белок попадает в мочу только тогда, когда ребенок встает.
Ортостатическая протеинурия является наиболее распространенной причиной положительного результата теста на белок у маленьких пациентов (часто высоких, худых, физически активных подростков). В этом случае обнаружение заболевания у бессимптомного человека на основе собранного образца, должно быть подтверждено повторением теста на образце.
Здоровый пациент с ортостатической протеинурией часто имеет значительное количество белка в 24-часовом сборе, возможно до 1000 мг, и может быть ошибочно идентифицирован как имеющий заболевание почек.
Дети, у которых есть это заболевание, не имеют повреждений почек, но по непонятной причине у них уменьшается количество белка. Ваш врач диагностирует это безвредное состояние, проверив 2 образца мочи.
Первый образец собираю утром, сразу после того, как ваш малыш встает. Второй — собирается в течение дня. Образцы хранятся в отдельных контейнерах. Если у вашего ребенка есть ортостатическая протеинурия, утренняя проба не будет содержать в себе протеин, но моча, собранная в течение дня, будет содержать в себе протеин.
Педиатр может захотеть повторить проверку мочи на белок, потому что тот часто уходит сам по себе (переходная протеинурия). Если его уровень по-прежнему выше нормы, доктор может попросить собрать 24-часовой анализ мочи. Этот анализ позволит врачу измерить количество белка в моче более точно. В некоторых случаях пациента отправляют на анализы крови.
Он заключается в систематическом сборе мочи ребенка в течение суток. Первая, собранная с утра моча не сохраняется, но нужно записать точное время, в которое первый раз был освобожден мочевой пузырь.
Каждый раз, когда ребенку нужно помочиться, он должен делать это в специальный контейнер, который на следующий день следует отдать врачу. Время каждого сбора мочи указывать не нужно. У девочек моча собирается в «шляпу» (устройство сбора образцов), а затем выливается в специальный контейнер. Контейнер с мочой стоит все время держать в холодильнике
Важно собрать всю мочу, которая выработается у ребенка в течение суток. На следующее утро примерно в то же время нужно произвести последний сбор и отнести мочу на анализ.
Если количество белка в моче незначительное, лечение не потребуется. В противном случае и при наблюдении опухоли ног и век, педиатр даст направление к нефрологу. Нефролог может провести биопсию почки. Маленький кусочек ткани почки вынимают, используя иглу, и смотрят под микроскопом.
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Протеинурия — экскреция белков с мочой, превышающая нормальные (30-50 мг/сут) значения, как правило, выступающая признаком поражения почек.

При наличии выраженной лейкоцитурии и особенно гематурии положительная качественная реакция на белок в моче обусловлена распадом клеточных элементов при длительном стоянии мочи; в этой ситуации патологической считают протеинурию, превышающую 0,3 г/сут.
Осадочные белковые пробы дают ложноположительные результаты при наличии в моче йодсодержащих контрастных веществ, большого количества антибиотиков (пенициллинов или цефалоспоринов), метаболитов сульфаниламидов.
В ранних стадиях развития большинства нефропатий в мочу проникают преимущественно низкомолекулярные плазменные белки (альбумин, церулоплазмин, трансферрин и др.). Однако возможно обнаружение и высокомолекулярных протеинов (альфа2-макроглобулина, у-глобулина), более типичных для выраженного поражения почек с «большой» протеинурией.
К селективной относят протеинурию, представленную белками с низкой молекулярной массой не более 65 000 кДа, главным образом альбумином. Неселективная протеинурия характеризуется повышением клиренса средне- и высокомолекулярных белков: в составе белков мочи преобладают а2-макроглобулин, бета-липопротеиды, у-глобулин. Кроме плазменных белков в моче определяют белки почечного происхождения — уропротеин Тамма-Хорсфолла, секретируемый эпителием извитых канальцев.
Клубочковая (гломерулярная) протеинурия обусловлена увеличением фильтрации плазменных белков через клубочковые капилляры. Это зависит от структурного и функционального состояния стенки клубочковых капилляров, свойств белковых молекул, давления и скорости кровотока, определяющих СКФ. Клубочковая протеинурия — обязательный признак большинства заболеваний почек.
Стенку клубочковых капилляров составляют эндотелиальные клетки (с округлыми отверстиями между ними), трехслойная базальная мембрана — гидратированный гель, а также эпителиальные клетки (подоциты) со сплетением ножковых отростков. Благодаря сложному строению клубочковая капиллярная стенка может «просеивать» плазменные молекулы из капилляров в пространство капсулы клубочка, причём эта функция «молекулярного сита» в значительной степени зависит от давления и скорости кровотока в капиллярах.
В патологических условиях размеры «пор» увеличиваются, отложения иммунных комплексов вызывают локальные изменения капиллярной стенки, повышают её проницаемость для макромолекул. Помимо размеров клубочковых «пор», важны и электростатические факторы. Клубочковая базальная мембрана заряжена отрицательно; отрицательный заряд несут на себе и ножковые отростки подоцитов. В нормальных условиях отрицательный заряд клубочкового фильтра отталкивает анионы — отрицательно заряженные молекулы (в том числе молекулы альбумина). Изменение заряда способствует фильтрации альбумина. Предполагают, что слияние ножковых отростков — морфологический эквивалент изменения заряда.
Канальцевая (тубулярная) протеинурия обусловлена неспособностью проксимальных канальцев реабсорбировать плазменные низкомолекулярные белки, профильтрованные в нормальных клубочках. Протеинурия редко превышает 2 г/сут, экскретируемые белки представлены альбумином, а также фракциями с ещё более низкой молекулярной массой (лизоцим, бета2-микроглобулин, рибонуклеаза, свободные лёгкие цепи иммуноглобулинов), отсутствующими у здоровых лиц и при клубочковой протеинурии в связи со 100% реабсорбцией эпителием извитых канальцев. Характерный признак канальцевой протеинурии — преобладание бета2-микроглобулина над альбумином, а также отсутствие высокомолекулярных белков. Канальцевую протеинурию наблюдают при поражении почечных канальцев и интерстиция: при тубулоинтерстициальном нефрите, пиелонефрите, калийпенической почке, остром канальцевом некрозе, хроническом отторжении почечного трансплантата. Канальцевая протеинурия характерна также для многих врождённых и приобретённых тубулопатий, в частности синдрома Фанкони.
Протеинурия «переполнения» развивается при повышении концентрации низкомолекулярных белков (лёгких цепей иммуноглобулинов, гемоглобина, миоглобина) в плазме крови. При этом данные белки фильтруются неизменёнными клубочками в количестве, превышающем способность канальцев к реабсорбции. Таков механизм протеинурии при множественной миеломе (протеинурии Бенс-Джонса) и других плазмоклеточных дискразиях, а также миоглобинурии.
Выделяетсят так называемая функциональная протеинурия. Механизмы развития и клиническое значение большинства её вариантов не известны.
- Ортостатическая протеинурия возникает при длительном стоянии или ходьбе («proteinuria en marche») с быстрым исчезновением в горизонтальном положении. При этом величина экскреции белков с мочой не превышает 1 г/сут. Ортостатическая протеинурия является клубочковой и неселективной и, по данным длительных проспективных исследований, всегда доброкачественна. При изолированном её характере отсутствуют другие признаки поражения почек (изменения в мочевом осадке, повышение артериального давления). Чаще наблюдается в юношеском возрасте (13-20 лет), у половины людей исчезает через 5-10 лет от момента возникновения. Характерно отсутствие белка в анализах мочи, взятых сразу после пребывания больного в горизонтальном положении (в том числе утром до подъёма с постели).
- Протеинурия напряжения, обнаруживаемая после интенсивных физических нагрузок не менее чем у 20% здоровых лиц, в том числе у спортсменов, по-видимому, также доброкачественна. По механизму возникновения её считают канальцевой, обусловленной перераспределением внутрипочечного кровотока и относительной ишемией проксимальных канальцев.
- При лихорадке с температурой тела 39-41 °С, особенно у детей и лиц пожилого и старческого возраста, обнаруживают так называемую лихорадочную протеинурию. Она является клубочковой, механизмы её развития не известны. Возникновение протеинурии у больного с лихорадкой иногда указывает на присоединение поражения почек; в пользу этого свидетельствуют одновременно возникающие изменения мочевого осадка (лейкоцитурия, гематурия), большие, особенно нефротические величины экскреции белков с мочой, а также артериальная гипертензия.
Протеинурия, превышающая 3 г/сут, — ключевой признак нефротического синдрома.
Значение протеинурии как маркёра прогрессирования поражений почек во многом обусловлено механизмами токсического действия отдельных компонентов белкового ультрафильтрата на эпителиоциты проксимальных канальцев и другие структуры почечного тубулоинтерстиция.
Компоненты белкового ультрафильтрата, оказывающие нефротоксическое действие
| Белок | Механизм действия |
| Альбумин |
- * RANTES (Regulated upon activation, normal T-lymphocyte expressed and secreted) — активируемая субстация, экспрессируемая и секретируемая нормальными Т-лимфоцитами.
- ** МАК — мембраноатакующий комплекс.
Многие мезангиоциты и гладкомышечные клетки сосудов претерпевают аналогичные изменения, означающие приобретение основных свойств макрофага. В почечный тубулоинтерстиций активно мигрируют моноциты из крови, также превращающиеся в макрофаги. Белки плазмы индуцируют процессы тубулоинтерстициального воспаления и фиброза, называемые протеинурическим ремоделированием тубулоинтерстиция.
Выраженность протеинурического ремоделирования тубулоинтерстиция — один из основных факторов, определяющих скорость прогрессирования почечной недостаточности при хронических нефропатиях. Зависимость увеличения концентрации сывороточного креатинина от величины протеинурии и распространённости тубулоинтерстициального фиброза неоднократно продемонстрирована для различных форм хронического гломерулонефрита и амилоидоза почек.

Протеинурия, как правило, выступает признаком заболеваний почек. Высокая («большая») протеинурия также рассматривается как маркёр тяжести и активности поражения почек.
По содержанию в плазме и моче определённых белков условно выделяют следующие типы протеинурии:
- протеинурия «переполнения»;
- функциональная протеинурия:
- ортостатическая;
- идиопатическая;
- протеинурия напряжения;
- лихорадочная протеинурия.

При количественном определении показателя экскреции белков с мочой в диапазоне величин, не превышающих 1 г/сут, пирогаллоловый метод имеет преимущества по чувствительности перед более распространённым сульфосалициловым.
Типы протеинурии дифференцируют с помощью определения отдельных белковых фракций в моче биохимическим и иммуногистохимическим методами.
Ортостатическая протеинурия подтверждается результатами специальной пробы: мочу собирают утром перед вставанием с постели, затем после пребывания в вертикальном положении (желательно после ходьбы с гиперлордозом) в течение 1-2 ч. Увеличение экскреции белков с мочой только во второй порции подтверждает ортостатическую протеинурию.

источник
Почечная (истинная) протеинурия бывает функциональной и органической. Среди функциональной почечной протеинурии наиболее часто наблюдаются следующие ее виды:
— физиологическая протеинурия новорожденных, которая исчезает на 4— 10-й день после рождения, а у недоношенных несколько позже;
— ортостатическая альбуминурия, которая характерна для детей в возрасте 7—18 лет и появляется только в вертикальном положении тела;
— транзиторная (инсультная) альбуминурия, причиной которой могут быть различные заболевания органов пищеварения, тяжелая анемия, ожоги, травмы или физиологические факторы: тяжелая физическая нагрузка, переохлаждение, сильные эмоции, обильная, богатая белком пища и др.
Органическая (почечная) протеинурия наблюдается вследствие прохождения белка из крови через поврежденные участки эндотелия почечных клубочков при заболеваниях почек (гломерулонефрит, нефроз, нефросклероз, амилоидоз, нефропатия беременных), расстройствах почечной гемодинамики (почечная венная гипертензия, гипоксия), трофических и токсических (в том числе лекарственных) воздействиях на стенки капилляров клубочков.
Большинство качественных и количественных методов определения белка в моче основаны на его коагуляции в объеме мочи или на границе сред (мочи и кислоты).
Среди качественных методов определения бедка в моче наибольшее распространение получили унифицированная проба с сульфосалициловой кислотой и кольцевая проба Геллера.
Унифицированная проба с сульфасалициловой кислотой проводится следующим образом. В 2 пробирки наливают по 3 мл профильтрованной мочи. В одну из них прибавляют 6—8 капель 20 % раствора сульфасалициловой кислоты. На темном фоне сравнивают обе пробирки. Помутнение мочи в пробирке с сульфасалициловой кислотой указывает на наличие белка. Перед исследованием необходимо определить реакцию мочи, и если она щелочная, то подкислить 2—3 каплями 10 % раствора уксусной кислоты.
Проба Геллера основана на том, что при наличии белка в моче на границе азотной кислоты и мочи происходит его коагуляция и появляется белое кольцо. В пробирку наливают 1—2 мл 30 % раствора азотной кислоты и осторожно по стенке пробирки наслаивают точно такое же количество профильтрованной мочи. Появление белого кольца на границе двух жидкостей указывает на наличие белка в моче. Следует помнить, что иногда белое кольцо образуется при наличии большого количества уратов, но в отличие от белкового кольца оно появляется несколько выше границы между двумя жидкостями и растворяется при нагревании [Плетнева Н.Г., 1987].
Из количественных методов наиболее часто применяются:
1) унифицированный метод Брандберга—Робертса—Стольникова, в основу которого положена кольцевая проба Геллера;
2) фотоэлектроколориметрический метод количественного определения белка в моче по помутнению, образующемуся при добавлении сульфасалициловой кислоты;
3) биуретовый метод.
Выявление белка в моче упрощенным ускоренным методом проводят колориметрическим методом с помощью индикаторной бумаги, которую выпускают фирмы «Lachema» (Словакия), «Albuphan», «Ames» (Англия), «Albustix», «Boehringer» (Германия), «Comburtest» и др. Метод заключается в погружении в мочу специальной бумажной полоски, пропитанной тетрабромфеноловым синим и цитратным буфером, которая меняет свой цвет от желтого до синего в зависимости от содержания белка в моче. Ориентировочно концентрацию белка в исследуемой моче определяют с помощью стандартной шкалы. Для получения правильных результатов необходимо соблюдать следующие условия. рН мочи должна быть в пределах 3,0—3,5; при слишком щелочной моче (рН 6,5) будет получен ложноположительный результат, а при слишком кислой моче (рН 3,0) — ложноотрицательный.
Бумага должна находиться в контакте с исследуемой мочой не дольше, чем указано в инструкции, в противном случае тест даст ложноположительную реакцию. Последнюю также наблюдают и при содержании в моче большого количества слизи. Чувствительность различных видов и серий бумаги может быть различной, поэтому к количественной оценке белка в моче этим методом следует относиться осторожно. Определение его количества в суточной моче при помощи индикаторной бумаги невозможно [Плетнева Н.Г., 1987]
Существует несколько способов определения количества белка, выделившегося с мочой за сутки. Наиболее простым является метод Брандберга —Робертса—Стольникова.
Методика. 5-10 мл тщательно перемешанной суточной мочи наливают в пробирку и осторожно по стенкам ее добавляют 30 % раствор азотной кислоты. При наличии белка в моче в количестве 0,033 % (т.е. 33 мг на 1 л мочи) через 2-3 мин появляется тонкое, но четко видимое белое кольцо. При меньшей его концентрации проба отрицательная. При большем содержании белка в моче его количество определяют путем многократных разведений мочи дистиллированной водой до тех пор, пока не перестанет образовываться кольцо. В последней пробирке, в которой еще видно кольцо, концентрация белка будет составлять 0,033 %. Умножив 0,033 на степень разведения мочи, определяют содержание белка в 1 л неразведенной мочи в граммах. Затем рассчитывают содержание белка в суточной моче по формуле:
где К — количество белка в суточной моче (г); х — количество белка в 1 л мочи (г); V — количество мочи, выделенное за сутки (мл).
В норме в течение суток с мочой выделяется от 27 до 150 мг (в среднем 40—80 мг) белка.
Указанная проба позволяет определить в моче только мелкодисперсные белки (альбумины). Более точные количественные методы (колориметрический метод Кьельдаля и др.) довольно сложны и требуют специальной аппаратуры.
При почечной протеинурии с мочой выделяются не только альбумины, но и другие виды белка. Нормальная протеинограмма (по Зейцу и соавт., 1953) имеет следующее процентное содержание: альбуминов — 20 %, α1-глобулинов — 12 %, α2-глобулинов — 17 %, γ-глобулинов — 43 % и β-глобулинов — 8 %. Отношение альбуминов к глобулинам изменяется при различных заболеваниях почек, т.е. нарушается количественное соотношение между белковыми фракциями.
Наиболее распространенными методами фракционирования уропротеинов являются следующие: высаливание нейтральными солями, электрофоретическое фракционирование, иммунологические методы (реакция радиальной иммунодиффузии по Манчини, иммуноэлектрофоретический анализ, преципитационный иммуноэлектрофорез), хроматография, гель-фильтрация, а также ультрацентрифугирование.
В связи с внедрением методов фракционирования уропротеинов, основанных на изучении электрофоретической подвижности, вариабильности молекулярной массы, размеров и формы молекул уропротеинов, появилась возможность выделять характерные для того или иного заболевания типы протеинурии, изучать клиренсы индивидуальных плазменных белков. К настоящему времени в моче идентифицировано свыше 40 плазменных белков, В том числе в нормальной моче 31 плазменный белок [Berggard, 1970].
В последние годы появилось понятие селективности протеинурии. В 1955 г. Hardwicke и Squire сформулировали понятие «селективная» и «неселективная» протеинурия, определив, что фильтрация плазменных белков в мочу подчиняется определенной закономерности: чем больше молекулярная масса белка, экскретируемого в мочу, тем меньше его клиренс и тем ниже концентрация его в окончательной моче. Протеинурия, соответствующая этой закономерности, является селективной в отличие от неселективной, для которой характерным является извращение выведенной закономерности.
Обнаружение в моче белков с относительно большой молекулярной массой свидетельствует об отсутствии избирательности почечного фильтра и выраженном его поражении. В этих случаях говорят о низкой селективности протеинурии. Поэтому в настоящее время широкое распространение получило определение белковых фракций мочи с использованием методов электрофореза в крахмальном и полиакриламидном геле. По результатам этих методов исследования можно судить о селективности протеинурии.
По данным В.С.Махлиной (1975), наиболее оправданным является определение селективности протеинурии путем сравнения клиренсов 6—7 индивидуальных белков плазмы крови (альбумина, транеферрина, α2 — макроглобулина, IgA, IgG, IgM) с использованием точных и специфичных количественных иммунологических методов реакции радиальной иммунодиффузии по Манчини, иммуноэлектрофоретического анализа и преципитального иммуноэлектрофореза. Степень селективности протеинурии определяют по индексу селективности, представляющего собой отношение сравниваемого и эталонного белков (альбумина).
Изучение клиренсов индивидуальных плазменных белков позволяет получить достоверные сведения о состоянии фильтрационных базальных мембран клубочков почки. Связь между характером экскретируемых в мочу белков и изменениями базальных мембран клубочков настолько выражена и постоянна, что по уропротеинограмме можно косвенно судить о патофизиологических изменениях в клубочках почек. В норме средний размер пор гломерулярной базальной мембраны составляет 2,9—4 А° НМ, которые могут пропускать белки, имеющие молекулярную массу до 10 4 (миоглобулин, кислый α1 — гликопротеин, легкие цепи иммуноглобулинов, Fc и Fab — фрагменты IgG, альбумин и трансферрин).
При гломерулонефрите, нефротическом синдроме размеры пор в базальных мембранах клубочков увеличиваются, в связи с чем базальная мембрана становится проницаемой для белковых молекул большого размера и массы (церулоплазмин, гаптоглобин, IgG, IgA и др.). При крайней степени повреждения клубочков почек в моче появляются гигантские молекулы белков плазмы крови (α2-макроглобулин, IgM и β2-липопротеин).
Определяя белковый спектр мочи, можно сделать заключение о преимущественном поражении тех или иных участков нефрона. Для гломерулонефрита с преимущественным поражением гломерулярных базальных мембран характерно наличие в моче крупно- и среднемолекулярных белков. Для пиелонефрита с преимущественным поражением базальных мембран канальцев характерны отсутствие крупномолекулярных и наличие повышенных количеств средне- и низкомолекулярных белков.
Концентрацию этого белка в плазме крови и моче определяют радиоиммунологическим методом с помощью стандартного набора «Phade-bas β2-mikroiest» (фирма «Pharmaсia», Швеция). В сыворотке крови здоровых людей содержится в среднем 1,7 мг/л (колебания от 0,6 до 3 мг/л), в моче — в среднем 81 мкг/л (максимально 250 мкг/л) β2-микроглобулина. Превышение его в моче свыше 1000 мкг/л — явление патологическое. Содержание β2-микроглобулина в крови увеличивается при заболеваниях, сопровождающихся нарушением клубочковой фильтрации, в частности при остром и хроническом гломерулонефрите, поликистозе почек, нефросклерозе, диабетической нефропатии, острой почечной недостаточности.
Концентрация β2-микроглобулина в моче повышается при заболеваниях, сопровождающихся нарушением реабсорбционной функции канальцев, что приводит к увеличению экскреции его с мочой в 10—50 раз, в частности, при пиелонефрите, ХПН, гнойной интоксикации и др. Характерно, что при цистите в отличие от пиелонефрита не наблюдается увеличения концентрации β2-микроглобулина в моче, что может быть использовано для дифференциальной диагностики этих заболеваний. Однако при интерпретации результатов исследования надо учитывать, что любое повышение температуры всегда сопровождается увеличением экскреции β2-микроглобулина с мочой.
Средние молекулы (СМ), иначе называемые белковыми токсинами, представляют собой вещества с молекулярной массой 500—5000 дальтон. Физическая структура их неизвестна. В состав СМ входят по меньшей мере 30 пептидов: окситоцин, вазопрессин, ангиотензин, глюкагон, адренокортикотропный гормон (АКТГ) и др. Избыточное накопление СМ наблюдается при снижении функции почек и содержании в крови большого количества деформированных белков и их метаболитов. Они обладают разнообразным биологическим действием и нейротоксичны, вызывают вторичную иммунодепрессию, вторичную анемию, угнетают биосинтез белка и эритропоэз, тормозят активность многих ферментов, нарушают течение фаз воспалительного процесса.
Уровень СМ в крови и моче определяют скрининговым тестом, а также путем спектрофотометрии в ультрафиолетовой зоне по длине волны 254 и 280 мм на спектрофотометре ДИ-8Б, а также динамической спектрофотометрии с компьютерной обработкой в диапазоне волн 220—335 нм на том же спектрометре фирмы Beckman. За норму принимают содержание СМ в крови, равное 0,24 ± 0,02 усл. ед., а в моче — 0,312 ± 0,09 усл. ед.
Будучи нормальными продуктами жизнедеятельности организма, они удаляются из него в норме ночками путем гломерулярной фильтрации на 0,5 %; 5 % их утилизируется другим путем. Все фракции СМ подвергаются канальцевой реабсорбции.
Кроме белков плазмы крови, в моче могут быть неплазменные (тканевые) протеины. По данным Buxbaum и Franklin (1970), неплазменные белки составляют приблизительно 2/3 всех биоколлоидов мочи и значительную часть уропротеинов при патологической протеинурии. Тканевые белки попадают в мочу непосредственно из почек или органов, анатомически связанных с мочевыми путями, или попадают из других органов и тканей в кровь, а из нее через базальные мембраны клубочков почки — в мочу. В последнем случае экскреция в мочу тканевых протеинов происходит аналогично выведению плазменных белков различной молекулярной массы. Состав неплазменных уропротеинов чрезвычайно разнообразен. Среди них гликопротеины, гормоны, антигены, ферменты (энзимы).
Тканевые протеины в моче выявляют с помощью обычных методов белковой химии (ультрацентрифугирование, гель-хроматография, различные варианты электрофореза), специфических реакций на ферменты и гормоны и иммунологических методов. Последние позволяют также определить концентрацию неплазменного уропротеина в моче и в ряде случаев определить тканевые структуры, ставшие источником его появления. Основным методом выявления в моче неплазменного белка является иммунодиффузионный анализ с антисывороткой, полученной иммунизацией экспериментальных животных мочой человека и истощенной (адсорбированной) в последующем белками плазмы крови.
При патологическом процессе наблюдаются глубокие нарушения жизнедеятельности клеток, сопровождающиеся выходом внутриклеточных ферментов в жидкостные среды организма. Энзимодиагностика базируется на определении ряда ферментов, выделившихся из клеток пораженных органов и не свойственных сыворотке крови.
Исследования нефрона человека и животных показали, что в отдельных его частях имеется высокая ферментативная дифференциация, тесно связанная с функциями, которые выполняет каждый отдел. В клубочках почки содержится относительно небольшое количество различных энзимов.
Клетки почечных канальцев, особенно проксимальных отделов, содержат максимальное количество энзимов. Высокая их активность наблюдается в петле Генле, прямых канальцах и собирательных трубочках. Изменения активности отдельных энзимов при различных заболеваниях почек зависят от характера, остроты и локализации процесса. Они наблюдаются до появления морфологических изменений в почках. Поскольку содержание различных ферментов четко локализовано в нефроне, определение того или иного фермента в моче может способствовать топической диагностике патологического процесса в почках (клубочки, канальцы, корковый или мозговой слой), дифференциальной диагностике почечных заболеваний и определению динамики (затухание и обострение) процесса в почечной паренхиме.
Дли дифференциальной диагностики заболеваний органов мочеполовой системы применяют определение активности в крови и моче следующих ферментов: лактатдегидрогеназы (ЛДГ), лейцинаминопептидазы (ЛАП), кислой фосфатазы (КФ), щелочной фосфатазы (ЩФ), β-глюкуронидазы, глютамино-щавелевоуксусной трансаминазы (ГЩТ), альдолазы, трансамидиназы и др. Активность ферментов в сыворотке крови и в моче определяют с помощью биохимических, спектрофотометрических, хроматографических, флуориметрических и хемилюминесцентных методов.
Энзимурия при заболеваниях почек более выражена и закономерна, чем энзимемия. Она особенно сильно выражена в острой стадии заболевания (острый пиелонефрит, травма, распад опухоли, инфаркт почки и т.д.). При этих заболеваниях обнаруживается высокая активность трансамидиназы, ЛДГ, ЩФ и КФ, гиалуронидазы, ЛАП, а также таких неспецифических энзимов, как ГЩТ, каталаза [Полянцева Л.Р., 1972].
Селективная локализация ферментов в нефроне при обнаружении ЛАП и ЩФ в моче позволяет с уверенностью говорить об острых и хронических заболеваниях почек (острая почечная недостаточность, некроз почечных канальцев, хронический гломерулонефрит) [Шеметов В.Д., 1968]. По данным А.А.Карелина и Л.Р.Полянцевой (1965), трансамидиназа содержится лишь в двух органах — почке и поджелудочной железе. Она является митохондриальным ферментом почек и в норме в крови и моче отсутствует. При различных заболеваниях почек трансамидиназа появляется в крови и в моче, а при поражении поджелудочной железы — только в крови.
Дифференциальным тестом в диагностике гломерулонефрита и пиелонефрита Krotkiewski (1963) считает активность ЩФ в моче, повышение которой более характерно для пиелонефрита и диабетического гломерулосклероза, чем для острого и хронического нефрита. Нарастающая в динамике амилаземия при одновременном снижении амилазурии может указывать на нефросклероз и сморщивание почки, ЛАП имеет наибольшее значение при патологических изменениях в клубочках и извитых канальцах почки, поскольку содержание ее в этих отделах нефрона более высокое [Шепотиновский В.П. и др., 1980]. Для диагностики волчаночного нефрита рекомендуется определение β-глюкуронидазы и КФ [Приваленко М.Н. и др., 1974].
При оценке роли энзимурии в диагностике заболеваний почек следует учитывать следующие положения. Энзимы, будучи по своей природе белками, при малой молекулярной массе могут проходить через неповрежденные клубочки, определяя так называемую физиологическую энзимурию. Среди этих энзимов постоянно определяются в моче α-амилаза (относительная молекулярная масса 45 ООО) и уропепсин (относительная молекулярная масса 38000).
Наряду с низкомолекулярными энзимами в моче здоровых лиц могут быть обнаружены в небольшой концентрации и другие энзимы: ЛДГ, аспартат- и аланинаминотрансферазы, ЩФ и КФ, мальтаза, альдолаза, липаза, различные протеазы и пептидазы, сульфатаза, каталаза, рибонуклеаза, пероксидаза [King, Воусе, 1963].
Высокомолекулярные энзимы с относительной молекулярной массой больше 70000-100000, по мнению Richterich (1958) и Hess (1962), могут проникать в мочу лишь при нарушении проницаемости клубочкового фильтра. Нормальное содержание ферментов в моче не позволяет исключить патологический процесс в почке при окклюзии мочеточника. При эпзимурии возможен выход энзимов не только из самих почек, но и из других паренхиматозных органов, клеток слизистых оболочек мочевых путей, предстательной железы, а также форменных элементов мочи при гематурии или лейкоцитурии.
Большинство энзимов неспецифично по отношению к почке, поэтому откуда происходят энзимы, обнаруженные в моче здоровых и больных, установить трудно. Однако степень энзимурии даже дли неспецифичных энзимов при поражении почек бывает выше нормы или той, которая наблюдается при заболеваниях других органов. Более ценную информацию может дать комплексное исследование в динамике ряда ферментов, особенно органоспецифичных, таких как трансаминаза.
В решении вопроса о почечном происхождении энзима в моче помогает исследование изоэнзимов с выявлением фракций, типичных для изучаемого органа. Изоэнзимы — это энзимы, изогенные по действию (катализируют одну и ту же реакцию), но гетерогенные по химической структуре и другим свойствам. Каждая ткань имеет характерный для нее изоэнзимный спектр. Ценными методами разделения изоэнзимов являются электрофорез в крахмальном и полиакриламидном геле, а также ионообменная хроматография.
При миеломной болезни и макроглобулинемии Вальденстрема в моче обнаруживают белок Бенс-Джонса. Метод обнаружения названного белка в моче основан на реакции термопреципитации. Применявшиеся ранее методы, с помощью которых оценивают растворение этого белка при температуре 100 °С и повторное осаждение при последующем охлаждении, ненадежны, так как не все белковые тела Бенс-Джонса обладают соответствующими свойствами.
Более достоверно выявление этого парапротеина путем осаждения его при температуре 40 -60 °С. Однако и в этих условиях осаждения может не произойти в слишком кислой (рН 6,5) моче, при низкой ОПМ и низкой концентрации белка Бенс-Джонса. Наиболее благоприятные условия для его осаждения обеспечивает методика, предложенная Patnem: 4 мл профильтрованной мочи смешивают с 1 мл 2 М ацетатного буфера рН 4,9 и согревают 15 мин на водяной бане при температуре 56 °С. При наличии белка Бенс-Джонса в течение первых 2 мин появляется выраженный осадок.
При концентрации белка Бенс-Джонса меньше 3 г/л проба может быть отрицательной, но на практике это встречается крайне редко, поскольку его концентрация в моче, как правило, более значительна. На пробы с кипячением нельзя вполне полагаться. С полной достоверностью он может быть обнаружен в моче иммуно-электрофоретическим методом с использованием специфических сывороток против тяжелых и легких цепей иммуноглобулинов.
источник