Кровь для исследования берется утром натощак из яремной вены, спустя 12-14 часов после последнего приема пищи. Отделение эритроцитов от сыворотки проводится методом центрифугирования при 1500 об/мин в течение 10 мин. (не позже одного часа с момента взятия крови).
Для диагностики метаболических нарушений у больных с мочекаменной болезнью проводится исследование 24-часовой порции мочи (таблица 24).
Таблица 24. Биохимический анализ суточной мочи
5.0 ммоль
> 8.0 ммоль — гиперкальциурия
Сбор и исследование суточной мочи трудоемоко, достаточно неудобно, требует наличия специальной лабораторной посуды и использования консервантов мочи. Применение консервантов может повлиять на результаты исследования. Кроме того, неправильный сбор мочи приводит к существенным ошибкам при анализе полученных результатов.
Альтернативой изучению суточной экскреции мочи является определение относительных биохимических показателей в утренней порции мочи. С этой целью в ней определяют концентрацию (ммоль/л) кальция, магния, неорганического фосфора, мочевой кислоты, оксалатов и рассчитывают концентрацию вышеперечисленных веществ по отношению к концентрации креатинина в моче (ммоль/л). Концентрация креатинина является постоянной величиной, которая зависит от клубочковой фильтрации, массы тела и возраста. У мужчин уровень креатинина (молекулярная масса 113,12) составляет примерно 0,17 — 0,24 ммоль/кг/сут (19,2 — 27,2 мг/кг/сут), а у женщин 0,13 — 0,19 ммоль/кг/сут (14,7 — 21,5 мг/кг/сут). Суточная экскреция мочевого креатинина может быть рассчитана с помощью формул Cockroft и Gaut [101]: у мужчин мочевой креатинин мг/сут = (28 — 0,20 x возраст в годах) x вес в кг; у женщчин мочевой креатинин мг/сут = (23,8 — 0,175 x возраст в годах) x вес в кг.
Определение общего кальция
Более 80 % мочевых камней содержат в своем составе кальций и образуются вследствие повышения его уровня в моче. С мочой у здорового человека выделяется менее 2 % профильтрованного кальция [13]. Основная часть кальция реабсорбируется в проксимальных почечных канальцах. Дистальная реабсорбция усиливается под влиянием ряда факторов: паратгормона, метаболического алкалоза, витаминов группы В. Это приводит к гиперкальциемии. Метаболический ацидоз, гипофосфатемия угнетают реабсорбцию кальция, что способствует гиперкальциурии. Витамины группы В, кроме того, оказывают влияние на кишечник, повышая всасывание кальция.
Требование к пробе.
Сыворотка натощак; брать кровь при минимальном пережатие вены, без мышечной нагрузки или после востановления кровобращения в течение более 1 минуты. Кальций стабилен в сыворотке крови в течении 24 ч при комнатной температуре (18-25 С), одну неделю при 2-8 С, в замороженной состоянии (- 20 С) 5 месяцев (пробы нельзя многократно размораживать).
Мочу перед определением кальция нужно подкислять до рН 2 для растворения солей кальция.
Методы определения.
Приблизительно 40% кальция связано с белком, преимущественно с альбумином. Остальная часть — свободная, либо формирует комплексы с органическими и неорганическими соединениями. Наибольшее значение для диагностики мочекаменной болезни играет измерение общего кальция. В настоящее время существует множество методов количественного определения кальция: атомно-абсорбционная спектроскопия, пламенно-фотометрический, флуорометрический и колориметрический методы. Принципы методов указаны в таблице 25. Наиболее чувствительным и точным методом является атомно-абсорционная спектроскопия.
Таблица 25. Биохимические методы определения кальция.
В клинической практике широко применяют унифицированный колориметрический метод с о-крезофталеинкомплексоном для определения кальция в сыворотке и моче. В кислых растворах хромофор формирует окрашенный комплекс с ионами кальция, с максимумом абсорбции на 578 нм. Определению кальция данным методом мешают соли тяжелых металлов и магний. Для повышения точности измерений к раствору добавляют цианистого калия, сульфат или ацетат натрия.
Оценка результатов. Нормальные величины в утренней пробе мочи: (кальций (ммоль/л)/креатинин (ммоль/л)): женщины — 0,06-0,50, мужчины — 0,04-0,52.
Наличие гиперкальциурии у здорового человека является фактором потенциального кристалло- и камнеобразования в мочевых путях. Существует 4 вида гиперкальциурии: абсорбтивная, почечная, резорбтивная и диетическая. Любой из этих типов гиперкациурии является фактором риска образования кальциевых камней. В зависимости от патогенетических механизмов выделяют три основные группы гиперкальциурии:
- Гиперкальциурия с гиперкальциемией (первичный гиперпаратиреоз);
- Гиперкальциурия без гиперкальциемии (идиопатическая гиперкальциурия, почечный канальциевый ацидоз, губчатая почка, синдром Иценко-Кушинга, применение кортикостероидов);
- Гиперкальциурия как с гиперкальциемией, так и без нее (высокие пищевые нагрузки кальцием, передозировка витамина D, саркоидоз, болезнь Педжета, карцинома, саркома или миелома, гиперпаратиреоз).
Тест с кальциевой нагрузкой
С целью уточнения формы гиперкальциурии применяется тест с кальциевой нагрузкой, суть которого заключается в ограничении приема кальция в течение 2-х дней. Утром натощак проводится исследование мочи. Затем пациент принимает 1 г кальция глюконата и через 4 часа после применения препарата опять исследуется моча. В ней исследуются уровни кальция и креатинина, и рассчитывается их соотношение: кальций (ммоль/л) / креатинин (ммоль/л) [103].
Нормальные величины: до нагрузки 0,56
Наиболее частая метаболическая аномалия, которая обнаруживается у 50-60 % больных с камнями из кальция оксалата. Считается, что у этих пациентов имеется повреждение интестинального ответа на витамин D, следствием чего является повышенная абсорбция кальция, повышение его уровня в сыворотке крови, снижение паратиреоидной функции и как результат повышение кальция, экскретируемого почками. Абсорбтивная гиперкальциурия наблюдается при саркоидозе [42].
Почечная гиперкальциурия
Почечная и резорбтивная гиперкальциурия: до нагрузки >0,34, после >0,56
Встречается примерно у 10 % пациентов с мочекаменной болезнью. Точная причина почечной потери кальция неизвестна, однако очевидна несостоятельность дистальных канальцев регулировать уровень кальция (нарушение процессов реабсорбции). Потеря кальция с мочой вызывает снижение его уровня в сыворотке крови, что приводит к повышению выработки паратгормона (вторичный гиперпаратиреоз), увеличению синтеза витамина D3 и усилению резорбции кальция из костной ткани.
Резорбтивная гиперкальциурия
- Наиболее часто данный тип гиперкальциурии, встречается при гиперпаратиреозе. Кость — это динамичное депо кальция, фосфора, магния и других элементов, необходимых для поддержания гомеостаза в минеральном обмене. До 99 % кальция и 66 % суммарного содержания фосфора содержится в костной ткани в виде фосфорно-кальциевых соединений. Фосфорно-кальциевый гомеостаз осуществляется тремя гормонами: паратгормоном, кальцитонином и витамином D [97, 104, 105].
- Переломы костей с длительной иммобилизацией. В данном случае гиперкальциурия связана с повышенной резорбцией кальция из костей за счет усиления активности остеобластов и остеокластов в зоне перелома. Кроме того, вынужденная гиподинамия приводит к уменьшению концентрации в крови молочной кислоты, что приводит к изменению минерального обмена с целью поддержания постоянства кислотно-основного состояния.
- Болезнь Кушинга. Гиперпродукция глюкокортикоидов и минералокортикодов приводит к резорбтивным процессам в кости (остеопороз) и увеличению мочевой экскреции кальция и магния.
- Гипертиреоз. Гормон щитовидной железы (тироксин), оказывая непосредственное ренотропное действие, усиливает фильтрацию и уменьшает реабсорбцию воды. Повышенная продукция тироксина снижает всасывание ионов кальция эпителием кишечника. Развивающаяся гипокальциемия приводит к вторичному гиперпаратиреозу и усилению резорбции кальция из костной ткани.
- Миеломная болезнь. Опухолевая, инвазирующая пролиферация плазмоцитов приводит к деструкции кости с резорбцией кальция и фосфора и усилению их экскреции [71].
Определение неорганического фосфора.
Регуляция метаболизма фосфора в организме осуществляется теми же гормональными факторами, что и обмен кальция: паратгормон, кальцитонин и витамин D. Фильтрации в клубочках подвергается от 3 до 20 % фосфатов. До 80 % профильтровавшегося фосфата реабсорбируется эпителием проксимальных отделов почечных канальцев. На эти процессы влияет целый ряд факторов, приводящих к гиперфосфатурии: перегрузка организма фосфатами с пищей, гиперпаратиреоз, гипергидратация организма, гиперкальциемия, нарушение кислотно-щелочного равновесия (алкалоз), инфекция мочевого тракта (протей, синегнойная палочка и др.), семейная предрасположенность (доминантный признак, сцепленный с X — хромосомой).
Прослеживается два механизма реабсорбции фосфатов, один из которых подавляется паратгормоном и возникает «фосфатурический эффект», другой стимулируется кальцием. Фосфатурия повышается в условиях алкализации мочи. Кальцитонин подавляет реабсорбцию фосфатов и таким образом оказывает фосфатурический эффект.
Требование к пробе.
Сыворотку следует отделять от сгустка так быстро, насколько это возможно. Неорганический фосфат стабилен в сыворотке крови в течение 1 недели при температуре 2-8 С, 3 недели в замороженном состоянии (- 20 С).
Мочу перед определением неорганического фосфора нужно подкислять до рН 4,5
источник
Где проводится: Во всех медицинских центрах и лабораториях «Тонус»
Срок выполнения: 3 рабочих дня
Исследование уровня экскреции кальция с мочой (кальциурии) является одним из наиболее часто выполняемых методов в нефрологии, поскольку биохимический анализ мочи может многое рассказать о состоянии мочевыделительной функции почек пациента.
Оба этих метода имеют свои положительные и отрицательные черты и не всегда могут быть выполнены с необходимой точностью. Определение кальция в разовой порции мочи не всегда дает максимально точный результат, так как, порция, собранная в разное время суток имеет различную степень концентрации, а значит – различные уровни кальция. Концентрация мочи зависит от питьевого режима пациента, а также, от времени суток, когда она была собрана (первая утренняя порция мочи, как правило, является наиболее концентрированной). Сбор суточной порции мочи не всегда возможен и не всегда удобен пациенту, тем более, что нельзя допускать пропусков в сборе мочи, иначе результат будет не достоверным.
Для повышения уровня достоверности результатов существует анализ, позволяющий исследовать уровень кальция в разовой порции мочи, но с поправкой на уровень креатинина плазмы крови, так называемое кальций-креатининовое соотношение. Уровень креатинина плазмы крови – величина относительно постоянная, это позволяет сгладить погрешности, выявляемые при суточных колебаниях концентрации мочи и микроэлементов в ней. Таким образом, кальций-креатининовое соотношение является наиболее точным методом диагностики экскреции кальция с мочой.
Для определения кальций-креатининового соотношения требуется разовая порция мочи. Обычно собирается вторая утренняя порция мочи (первая, получаемая непосредственно после сна, пропускается).
Забор материала осуществляется в стерильный контейнер.
- Обменные нарушения почек
- Мочекаменная болезнь
- Диагностика дисметаболической нефропатии
- Контроль эффективности лечения пациентов с патологией почек
- Контроль лечения пациентов препаратами витамина D
- Заболевания костной системы
- 0 — 6 мес. – 0,1 — 2,6 ммоль/ммоль;
- 6 — 12 мес. – 0,09 — 2,2 ммоль/ммоль;
- 1 — 2 года – 0,07 — 1,5 ммоль/ммоль;
- 2 — 3 года – 0,06 — 1,4 ммоль/ммоль;
- 3 — 5 лет – 0,05 — 1,1 ммоль/ммоль;
- 5 — 7 лет – 0,04 — 0,8 ммоль/ммоль;
- 7 — 10 лет – 0,04 — 0,7 ммоль/ммоль;
- 10 — 14 лет – 0,04 — 0,6 ммоль/ммоль;
- 14 — 17 лет – 0,04 — 0,6 ммоль/ммоль.
- Передозировке витамином D (гипервитаминоз)
- Патологией со стороны паращитовидных желез – гиперпаратиреоз
- Заболевания костной ткани (остеопороз)
- Дистальный почечный канальцевый ацидоз (разновидность тубулопатии)
- Тиреотоксикоз
- Болезнь Педжета
- Миеломная болезнь
- Влияние некоторых лекарственных препаратов (глюкокортикостероиды, диуретические препараты и т.д.)
- Гипопаратиреоза
- Рахита
- Явлений остеомаляции
- Нефроза или острого нефрита
- Целиакии
- Гипокальциурической гипокалциемии
Более 20 клиник по Нижнему Новгороду и области
Собственная бактериологическая лаборатория
База кафедры клинической лабораторной диагностики НижГМА
Авторские права © 1999 — 2019 Лаборатория «Тонус». Все права защищены.
источник
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Определение концентрации биологических молекул в моче, отражающих функции различных органов и систем, прежде всего мочевыделительной, называется биохимическим анализом мочи.
Чаще всего в биохимическом анализе мочи определяют концентрации следующих веществ:
- мочевина;
- креатинин;
- креатин;
- мочевая кислота;
- амилаза мочи (диастаза);
- электролиты мочи (калий, натрий, кальций, магний, фосфор).
Кроме вышеперечисленных веществ, в моче можно определять концетрации многих других факторов для повышения точности диагностики. Определение мочевины, креатинина, креатина, мочевой кислоты и амилазы имеет высокое диагностическое значение в идентификации различных патологий почек. Рассмотрим подробнее клинико-диагностическое значение определения концентрации данных биологических веществ.
Мочевина образуется в организме каждый день при утилизации белковых структур, и выводится почками в количестве 12-36 грамм в сутки.
Концентрация мочевины в моче зависит от двух факторов:
1. Концентрация мочевины в крови.
2. Величина фильтрации мочевины почками.
Изменение любого из этих факторов приведет к повышению или понижению концентрации мочевины. У здорового человека в норме концентрация мочевины крови составляет 2,8 – 8,3 ммоль/л, а в моче – 330-580 ммоль/сутки. В моче целесообразно определять концентрацию мочевины во всей суточной порции, поскольку данное вещество выделяется порционно. Таким образом, в одной порции мочи концентрация мочевины может быть высокой, а в другой вещество будет практически отсутствовать.
Поэтому для определения концентрации мочевины собирают всю мочу, выделяемую в течение суток, сливают в одну емкость и перемешивают. В данной суточной порции определяют среднюю концентрацию мочевины, и выражают в ммоль/сутки, что отражает количество вещества, выделенного почками на протяжении 24 часов.
Увеличение концентрации мочевины в моче называется урурия или азотурия. Повышение концентрации мочевины может быть вызвано физиологическими причинами, то есть не свидетельствует о патологии. Данное состояние обычно наблюдается при диете с большим количеством белковой пищи (мясо, рыба и т.д.) или в период беременности.
Повышение концентрации мочевины также может вызываться патологическим причинами. Чаще всего данное состояние провоцируется сахарным диабетом или высокой функциональной активностью щитовидной железы (гипертиреозом).
Более редкие причины повышения концентрации мочевины:
- атрофия мышц;
- отравления фосфором;
- воспалительные заболевания органов мочевыделительной системы (почек, уретры, мочевого пузыря и т.д.);
- гепатиты;
- недостаток витаминов Е, В1;
- дефицит селена;
- нарушения гормонального баланса;
- послеоперационный период.
Снижение концентрации мочевины в моче встречается достаточно редко. Физиологические варианты уменьшения концентрации мочевины наблюдаются в периоды восстановления после перенесенных заболеваний или активного роста, например, у детей или беременных женщин. Безбелковая диета (вегетарианская) также приводит к снижению концентрации мочевины в моче.
Патологическое снижение концентрации мочевины в моче выявляется при следующих патологиях:
- Лечение гормональными препаратами (тестостерона, инсулина, соматотропного гормона и т.д.).
- Патология печени (гепатиты, цирроз, дистрофия, опухоли или метастазы в печень).
- Патология почек (гломерулонефриты, пиелонефриты и т.д.).
Чтобы различить изменение концентрации мочевины почечного происхождения от внепочечного, используют параллельное выявление данного параметра в крови. Различное соотношение концентраций мочевины в крови и моче позволяет уточнить окончательный диагноз.
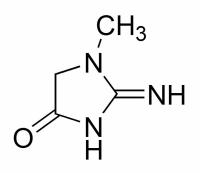
Увеличение концентрации креатинина в моче называется креатининурией. Она является диагностическим критерием почечной патологии.
Креатининурия наблюдается при следующих состояних:
- сильные физические нагрузки;
- пониженная функция щитовидной железы;
- диета с высоким содержанием белка (мясо, рыба, сыры и т.д.);
- сахарный диабет;
- патология гипофиза (акромегалия).
Помимо повышенной концентрации, наблюдается понижение содержания креатинина в моче.
Низкий уровень креатинина обусловлен следующими патологическими состояними:
- анемия;
- повышенная функция щитовидной железы;
- лейкоз;
- диета со сниженным содержанием белка (например, строгая вегетарианская);
- дистрофические заболевания мышц;
- тяжелая патология почек (нефросклероз, гломерулонефрит, хроническая почечная недостаточность);
- сужение почечной артерии.
Кроме простого определения концентрации креатинина в моче, для диагностики заболеваний почек применяют расчет различных коэффициентов. Диагностическое значение определения концентрации креатинина в моче и крови с последующим вычислением коэффициента фильтрации и реабсорбции имеет огромное значение для выявления заболеваний почек, и контроля над их функциональным состоянием на фоне длительно текущих хронических патологий. Чтобы рассчитать коэффициент почечной фильтрации и реабсорбции, используется проба Реберга.
Проба Реберга отражает клиренс креатинина, который представляет собой количество крови в миллилитрах, очищаемое при прохождении через почки в течение одной минуты. То есть проба Реберга отражает способность почек к очищению крови.
Чтобы получить правильный результат анализа, который отражает очистительную функцию почек, важно полностью следовать правилам сдачи пробы. Проба Реберга правильно сдается следующим образом: утром встаньте и помочитесь, полностью освободив мочевой пузырь от скопленной за ночь мочи. Отметьте время мочеиспускания. После чего выпейте два стакана воды, но не кушайте. Воду можно заменить слабым, слегка подслащенным чаем. Через час после мочеиспускания необходимо сдать кровь из вены для определения концентрации креатинина. Еще через час, то есть через два часа после утреннего мочеиспускания, необходимо помочиться. При этом следует собрать в емкость всю выделенную мочу. В промежутке между первым и вторым мочеиспусканием посещать туалет не следует.
Пример сбора мочи для пробы Реберга. Подъём в 7.00, помочиться, выпить два стакана воды, ровно через час в 8.00, сдать кровь из вены, а еще через час в 9.00, помочиться в банку (собрать всю мочу!). Между 7.00 и 9.00 – не мочиться!
Для вычисления клиренса креатинина (скорости фильтрации) и реабсорбции определяют следующие параметры:
1. Концентрация креатинина в моче и крови.
2. Объем выделенной мочи в мл.
Затем на основании специальной формулы производят расчет скорости фильтрации и реабсорбции. В норме клиренс креатинина составляет 80-120 мл/мин, а реабсорбция – 95-97%. Повышение значений пробы Реберга наблюдается при сахарном диабете, повышенном артериальном давлении, а также нефротическом синдроме. Снижение значений клубочковой фильтрации возможно при пиелонефрите, гломерулонефрите, почечной недостаточности, гломерулосклерозе (у людей, долго страдающих гипертонией и сахарным диабетом). У больных почечной недостаточностью пробу Реберга используют для контроля над функцией почек. При снижении клубочковой фильтрации до 5-15 мл/мин больного необходимо подключать к аппарату «искусственная почка», или проводить операцию по пересадке почки.
Биологические жидкости женщин содержат большее количество креатина, по сравнению с мужчинами. Так, нормальная концентрация креатина в крови доходит до 122 мкмоль/л, а в моче – до 380 мкмоль/сутки. При превышении верхнего предела в 122 мкмоль/л в крови, креатин проникает и в мочу. Креатин в моче может появляться вследствие физиологических или патологических причин. В первом случае данный результат анализа является вариантом нормы, а во втором — говорит о наличии заболевания.
Физиологические причины появления креатина в моче:
- заживление переломов;
- послеродовой период;
- диета с низким содержанием углеводов или белков.
Патологические причины увеличения концентрации креатина в моче:
- нефриты (гломерулонефрит, пиелонефрит, интерстициальный нефрит);
- гепатиты;
- заболевания мышц;
- переохлаждение;
- ожоговая травма;
- судорожные состояния, в том числе эпилепсия;
- сахарный диабет;
- переломы костей;
- дефицит витамина Е;
- голодание;
- некоторые инфекционные заболевания (столбняк);
- усиленная функция щитовидной железы (гипертиреоз).
Снижение концентрации креатина в моче наблюдается при сниженной активности щитовидной железы (гипотиреоз).
Мочевая кислота образуется в результате распада пуринов, являющихся составными частями молекулы ДНК. Образуется мочевая кислота преимущественно в печени, а выводится почками. В норме у здорового взрослого человека выделяется 23,8 – 29,6 ммоль/сутки мочевой кислоты с мочой. Диета с высоким содержанием пуринов (мясо, кофе, шоколад, красное вино и т.д.) приводит к повышению концентрации мочевой кислоты.
Увеличение концентрации мочевой кислоты в моче происходит при следующих заболеваниях:
- рак крови (лейкемия, полицитемия);
- вирусный гепатит;
- серповидно-клеточная анемия;
- пневмония;
- эпилепсия;
- подагра.
Лечение с применением ацетилсалициловой кислоты (аспирина) и кортикостероидных гормонов также способствует увеличению концентрации мочевой кислоты в моче.
Самая распространенная причина повышения концентрации мочевой кислоты в моче – это патология обмена веществ, называемая подагра. При подагре образование мочевой кислоты в организме, или поступление извне с пищей, резко повышено, а почки выводят только часть вещества. В итоге кристаллы мочевой кислоты начинают депонироваться в почках, суставах, коже и т.д.
Снижение концентрации мочевой кислоты в моче может быть обусловлено несбалансированной диетой с низким содержанием пуринов, или дефицитом витамина В9 (фолиевой кислоты).
Патологические причины снижения концентрации мочевой кислоты в моче:
- отравление соединениями свинца;
- прогрессирующая атрофия мышц;
- прием медикаментов (калий йодид, хинин, атропин).
Причины повышения активности амилазы мочи:
- панкреатиты (острый или обострение хронического);
- свинка (эпидемический паротит);
- перитонит;
- внематочная беременность;
- острый аппендицит;
- колиты;
- перфорация язв желудка и кишечника;
- острая травма живота.
Наиболее часто активность амилазы мочи применяют для диагностики панкреатитов, и контроля над эффективностью лечения данного заболевания.
Уменьшение активности диастазы мочи наблюдается редко, и сопровождает сахарный диабет, почечную недостаточность или длительную закупорку желчного протока камнем при калькулезном холецистите.
Концентрация кальция в моче различается в зависимости от возраста. Так, нормальная концентрация кальция у детей составляет 0 – 10,5 ммоль/сут, а у взрослых людей – 2,5 – 7,5 ммоль/сут.
Определение концентрации кальция в суточной моче производят с целью изучения следующих состояний организма:
- определение функциональной активности паращитовидных желез;
- определение степени остеопороза;
- выявление рахита и контроль эффективности его терапии;
- выявление патологии костной системы;
- диагностика патологии гипофиза и щитовидной железы.
Перед сбором суточной мочи для определения концентрации кальция необходимо прекратить прием мочегонных препаратов.
Физиологические причины увеличения концентрации кальция в моче (гиперкальциурии):
- диета с высоким содержанием кальция (например, молочная);
- состояние дефицита движения;
- длительное пребывание на солнце;
- прием некоторых лекарств (например, фуросемида и витамина D).
Патологические причины развития гиперкальциурии:
- гиперпаратиреоз;
- синдром Иценко-Кушинга;
- акромегалия;
- остеопороз;
- опухоли;
- повышенная активность щитовидной железы (тиреотоксикоз).
Снижение концентрации кальция в моче называется гипокальциурией, и может наблюдаться только при одной физиологической причине – несбалансированная диета с дефицитом микроэлементов.
Патологические причины развития гипокальциурии:
- низкая активность паращитовидных и щитовидной желез (гипопаратиреоз, псевдогипопаратиреоз, гипотиреоз);
- рахит;
- нефрозы;
- нефриты;
- опухоли и метастазы в кость.

Повышение концентрации магния в моче называется гипермагниурия, а снижение – гипомагниурия. Причины развития данных патологических состояний отражены в таблице:
| Изменение концентрации магния в моче относительно нормы | Причины изменения концентрации магния в моче |
| Увеличение концентрации магния в моче (гипермагниурия) |
|
| Уменьшение концентрации магния в моче (гипомагниурия) |
|
Калий является очень важным микроэлементом, который выполняет большой спектр функций. Концентрация калия в моче может колебаться в зависимости от особенностей питания, возраста, кислотно-основного равновесия в организме, а также использования медицинских средств. Нормальная концентрация калия в моче у детей составляет 10-60 ммоль/сут, а у взрослых – 30-100 ммоль/сут.
Определение концентрации кальция в моче используют для оценки сбалансированности рациона, оценки гормональных изменений и симптомов интоксикации, а также выявления заболеваний почек.
Причины повышения и понижения концентрации калия в моче указаны в таблице:
| Изменение концентрации калия в моче относительно нормы | Причины изменения концентрации калия в моче |
| Увеличение концентрации калия в моче (гиперкалиурия) |
|
| Уменьшение концентрации калия в моче (гипокалиурия) |
|
Концентрация натрия в моче определяется соотношением между его поступлением, выделением и участием в обменных процессах. Концентрация натрия зависит, прежде всего, от возраста и состояния кислотно-основного равновесия. Для детей нормальная концентрация натрия в моче составляет 10 – 170 ммоль/сут, а для взрослых – 130 – 260 ммоль/сут.
Определение концентрации натрия в моче необходимо для выявления почечных заболеваний, для контроля над пищевым рационом. Также концентрацию натрия в моче контролируют при длительном применении мочегонных препаратов, тяжелом течении сахарного диабета и получении черепно-мозговой травмы.
Причины повышения и понижения концентрации натрия в моче отражены в таблице:
| Изменение концентрации натрия в моче относительно нормы | Причины изменения концентрации натрия в моче |
| Увеличение концентрации натрия в моче (гипернатриурия) |
|
| Уменьшение концентрации натрия в моче (гипонатриурия) |
|
Определение концентрации фосфора в моче производят с целью выявления патологии костей, паращитовидных желез и почек. Терапию витамином D также проводят под контролем данных показателей.
Причины повышения и снижения концентрации фосфора в моче представлены в таблице:
| Изменение концентрации фосфора в моче относительно нормы | Причины изменения концентрации фосфора в моче |
| Увеличение концентрации фосфора в моче (гиперфосфоурия) |
|
| Уменьшение концентрации фосфора в моче (гипофосфоурия) |
|
Биохимический анализ мочи представляет собой высокую диагностическую ценность, а также позволяет контролировать проводимое лечение, корректировать дозы применяемых медицинских препаратов или судить о динамике патологического процесса. Несмотря на большое количество информации, получаемой с помощью биохимического анализа мочи, одних лишь результатов недостаточно для постановки правильного диагноза. Диагностика проводится на основании изучения комплекса клинических симптомов и данных других лабораторных, а также объективных исследований.
Автор: Наседкина А.К. Специалист по проведению исследований медико-биологических проблем.
источник
Образованию камней в почках предшествует нарушение обмена литогенных веществ. В ходе данного исследования определяются литогенные факторы камнеобразования.
- Креатинин
- Магний
- Соотношение магний/креатинин
- Мочевая кислота
- Соотношение мочевая кислота/креатинин
- Оксалаты
- Соотношение оксалат/креатинин
- Фосфор
- Соотношение фосфор/креатинин
- Кальций
- Соотношение кальций/креатинин
Энзиматический, кинетический (Яффе), О-крезолфталеиновый, колориметрический.
Ммоль/ммоль креат. (миллимоль на миллимоль креатинина).
Какой биоматериал можно использовать для исследования?
Разовую, суточную порцию мочи.
Как правильно подготовиться к исследованию?
- Полностью исключить (по согласованию с врачом) прием лекарственных препаратов в течение 24 часов перед исследованием.
Общая информация об исследовании
Уролитиаз — полиэтиологическое заболевание, манифестирующее при наличии врождённых и приобретенных факторов или сочетанного воздействия экзогенных литогенных воздействий на фоне существующих субклинических эндогенных нарушений. При этом те или иные причины могут присоединяться и исчезать на всех этапах течения болезни. Моча по сути — сложный раствор различных веществ минерального и органического обмена. Составные ее части находятся в растворенном виде. При нарушении функции почек изменяется устойчивость мочевых растворов. К веществам, содержащимся в моче и играющим важную роль в камнеобразовании, относятся следующие:
1) Пролитогенные: кальций, оксалаты, фосфаты, мочевая кислота, цистин, ксантин и т.д.
2) Антилитогенные: цитрат, магний, цинк, сульфаты, фториды, некоторые белки с N-концевой последовательностью аминокислот и высоким содержанием остатков кислых аминокислот.
Нарушение обмена литогенных веществ предшествует образованию камней. В ходе данного исследования определяются литогенные факторы камнеобразования. Под воздействием различного сочетания экзогенных, эндогенных генетических и приобретенных местных и общих факторов возникают метаболические нарушения, сопровождаемые повышением концентрации литогенных веществ (кальция, фосфатов, щавелевой и мочевой кислот, цистина, белковых компонентов и других веществ) в сыворотке крови, которое приводит к повышению выделения их почками, что отражается при анализе мочи.
Более 80 % мочевых камней содержат в своем составе кальций и образуются вследствие повышения его уровня в моче.
Регуляция метаболизма фосфора в организме осуществляется теми же гормональными факторами, что и обмен кальция: паратгормон, кальцитонин и витамин D. Фильтрации в клубочках подвергается от 3 до 20 % фосфатов. До 80 % профильтровавшегося фосфата реабсорбируется эпителием проксимальных отделов почечных канальцев. На эти процессы влияет целый ряд факторов, приводящих к гиперфосфатурии: перегрузка организма фосфатами с пищей, гиперпаратиреоз, гипергидратация организма, гиперкальциемия, нарушение кислотно-щелочного равновесия (алкалоз), инфекция мочевого тракта (протей, синегнойная палочка и др.), семейная предрасположенность (доминантный признак, сцепленный с X-хромосомой).
Магний называют «естественным физиологическим блокатором кальция», так как он способствует снижению концентрации кальция. Ион магния является активатором многих ферментов, оказывает влияние на выделение щавелевой кислоты и повышает растворимость фосфата кальция. Считается, что нефролитиаз сопровождается гипомагниурией и встречается примерно у 30-50 % больных мочекаменной болезнью. Магний также регулирует стабильность мочи от пересыщенного раствора и препятствует кристаллизации.
Мочевая кислота является продуктом метаболизма пуриновых оснований в организме человека. Реакция мочи является одним из наиболее существенных факторов в патогенезе образования камней из мочевой кислоты. Мочевая кислота в недиссоциированной форме относительно нерастворима, но в диссоциированной форме растворимость ее резко возрастает. Это означает, что при слабокислой или нейтральной реакции мочи мочевая кислота даже при высокой концентрации не выпадает в осадок и находится в ионизированном (растворенном) состоянии. При снижении рН мочи растворимость мочевой кислоты резко падает, так как большая часть ее переходит в неионизированную форму, которая плохо растворима и легко выпадает в кристаллический осадок.
При скрининговом обследовании для выявления гиперкальциурии информативно сравнение соотношения содержания кальция и креатинина в моче. Если расчетное соотношение выше нормы, показано повторное исследование. У новорождённых и грудных детей экскреция кальция повышена, а экскреция креатинина ниже, чем у детей более старшего возраста. Если при динамическом наблюдении соотношения нормальны, дополнительного обследования по поводу гиперкальциурии не требуется. Однако если это соотношение остается повышенным, следует провести сбор суточной мочи и рассчитать экскрецию кальция.
Данное комплексное исследование является неинвазивным скрининговым тестом и особенно актуально в педиатрической практике. Осуществляется количественное определение соотношения концентрации литогенных веществ к концентрации креатинина; а также оценка активности литогенеза.
Когда назначается исследование?
- При комплексной оценке риска почечного камнеобразования;
- при комплексной оценке риска образования мочевых камней;
- при наличии факторов, предрасполагающих к развитию уролитиаза: врождённые и приобретенные заболевания, приводящие к нарушениям метаболизма, наследственная предрасположенность, инфекции;
- при несбалансированной диете, дегидратации, индивидуальных анатомических особенностях;
- при дисметаболических нефропатиях у детей;
- при наследственной патологии обмена глиоксиловой кислоты (мочевой синдром с оксалатно-кальциевой и/или фосфатно-кальциевой кристаллурией, гематурия, протеинурия и/или лейкоцитурия абактериального характера);
- при контроле терапии нефролитиаза;
- при оценке риска камнеобразования в тех случаях, когда сбор суточной мочи представляется затруднительным, например в педиатрической практике.
1. Концентрация, мкмоль/л: креатинин, магний, мочевая кислота, оксалаты, фосфор, кальций
Референсные значения для данных веществ при анализе порции мочи не предоставляются — указывается сама определенная концентрация.
Реф. значения (ммоль/ммоль креат.)
источник
В цены на исследования не входит стоимость расходных материалов и услуги взятия биоматериала.
Эти расходы оплачиваются дополнительно, их размер может варьироваться в зависимости от особенностей выбранного исследования. Получить подробную информацию о стоимости исследований можно по телефону единой справочной службы ИНВИТРО: 8(017)222-21-31 или 8(029) 685-41-41.
Указанный срок не включает день взятия биматериала.
Анализ концентрации кальция в случайных разовых порциях мочи в течение дня дает приблизительный результат, поскольку на концентрацию микроэлемента в выделяемой моче в определенной степени влияет питьевой режим. Сбор мочи в течение суток для оценки усредненной суточной экскреции кальция с мочой сложен для пациента, особенно трудно его обеспечить детям самого младшего возраста. Повысить точность оценки степени кальциурии по разовой случайной порции мочи позволяет поправка на уровень креатинина в моче (расчет кальций-креатининового соотношения в разовой порции мочи), которая сглаживает колебания результата, связанные со степенью концентрирования мочи в зависимости от предшествующего питьевого режима.
Тест на кальций-креатининовое соотношение в разовой порции мочи используется в педиатрической практике для контроля терапии витамином D во избежание передозировки. При выявлении повышенного уровня кальция в пробе проводится коррекция терапии или дальнейшее исследование (тест №113 Кальций в суточной моче ).
Тест может быть использован для оценки уровня выделения кальция с мочой в тех случаях, когда сбор суточной мочи для оценки суточной экскреции кальция представляется затруднительным.
Данный тест выполняется в комплексе с тестом № CREA-U. Тест № CREA-U нельзя заказать отдельно.
- Вощула В.И. Мочекаменная болезнь: этиотропное и патогенетическое лечение, профилактика. — Мн.: Изд. «ВЭВЭР». 2006:268.
- Клиническое руководство Тица по лабораторным тестам. 4-е издание. Под ред. А. Ву. Пер. с англ. В.В. Меньшикова. — М.: Изд. «Лабора». 2013:1279.
- Мазо А.М., Цыгин А.Н., Зоркин С.Н., Акопян А.И. Фракционная экскреция натрия и литогенные субстанции в моче у детей с уролитиазом. Нефрология и диализ. 2010;12(4):301-305.
- Erol İ., Buyan N., Özkaya O., Şahin F., Beyazova U., Söylemezoğlu O., Hasanoğlu E. Reference values for urinary calcium, sodium and potassium in healthy newborns, infants and children. Turkish Journal of Pediatrics. 2009;51:6-13.
- Вощула В.И. Мочекаменная болезнь: этиотропное и патогенетическое лечение, профилактика. — Мн.: Изд. «ВЭВЭР». 2006:268.
- Клиническое руководство Тица по лабораторным тестам. 4-е издание. Под ред. А. Ву. Пер. с англ. В.В. Меньшикова. — М.: Изд. «Лабора». 2013:1279.
- Мазо А.М., Цыгин А.Н., Зоркин С.Н., Акопян А.И. Фракционная экскреция натрия и литогенные субстанции в моче у детей с уролитиазом. Нефрология и диализ. 2010;12(4):301-305.
- Erol İ., Buyan N., Özkaya O., Şahin F., Beyazova U., Söylemezoğlu O., Hasanoğlu E. Reference values for urinary calcium, sodium and potassium in healthy newborns, infants and children. Turkish Journal of Pediatrics. 2009;51:6-13.
- контроль терапии витамином D в педиатрии;
- оценка нарушений метаболизма кальция;
- заболевания костной ткани;
- оценка риска образования почечных камней.
- Вощула В.И. Мочекаменная болезнь: этиотропное и патогенетическое лечение, профилактика. — Мн.: Изд. «ВЭВЭР». 2006:268.
- Клиническое руководство Тица по лабораторным тестам. 4-е издание. Под ред. А. Ву. Пер. с англ. В.В. Меньшикова. — М.: Изд. «Лабора». 2013:1279.
- Мазо А.М., Цыгин А.Н., Зоркин С.Н., Акопян А.И. Фракционная экскреция натрия и литогенные субстанции в моче у детей с уролитиазом. Нефрология и диализ. 2010;12(4):301-305.
- Erol İ., Buyan N., Özkaya O., Şahin F., Beyazova U., Söylemezoğlu O., Hasanoğlu E. Reference values for urinary calcium, sodium and potassium in healthy newborns, infants and children. Turkish Journal of Pediatrics. 2009;51:6-13.
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Единицы измерения: ммоль/ммоль (кальций-креатинин).
Референсные значения:
- 0 — 6 мес. – 0,1 — 2,6 ммоль/ммоль;
- 6 — 12 мес. – 0,09 — 2,2 ммоль/ммоль;
- 1 — 2 года – 0,07 — 1,5 ммоль/ммоль;
- 2 — 3 года – 0,06 — 1,4 ммоль/ммоль;
- 3 — 5 лет – 0,05 — 1,1 ммоль/ммоль;
- 5 — 7 лет – 0,04 — 0,8 ммоль/ммоль;
- 7 — 10 лет – 0,04 — 0,7 ммоль/ммоль;
- 10 — 14 лет – 0,04 — 0,6 ммоль/ммоль;
- 14 — 17 лет – 0,04 — 0,6 ммоль/ммоль.
Старше 17 лет:
- мужчины – 0,03 — 0,7 ммоль/ммоль,
- женщины – 0,03 — 0,93 ммоль/ммоль
Интерпретация результатов
Повышение значений:
- передозировка витамина D (в контроле терапии витамином D);
- длительное воздействие солнечных лучей;
- гиперпаратиреоз;
- остеопороз (особенно после иммобилизации, при синдроме Иценко-Кушинга, акромегалии);
- дистальный почечный канальцевый ацидоз;
- тиреотоксикоз;
- болезнь Педжета;
- миеломная болезнь;
- лекарственные интерференции (в т. ч. при приеме диуретиков, кортикостероидов, холестирамина, витамина D и пр.).
Понижение значений:
- гипопаратиреоз, псевдогипопаратиреоз;
- рахит;
- остеомаляция;
- гипокальциемия;
- нефроз, острый нефрит;
- гипотиреоз;
- целиакия;
- стеаторея;
- гипокальциурическая гиперкальциемия.
источник
Рассмотрены патогенетические механизмы формирования мочекаменной болезни в детском возрасте, метаболические аспекты камнеобразования при кальциевых, уратных, цистеиновых, струвитных конкрементах. Обсуждены вопросы диагностики метаболических нарушений, пат
Pathogenic mechanisms of urolithiasis formation in childhood were considered, as well as metabolic aspects of stone formation in calcium, urate, cysteine, struvite concretions. Issues of metabolic disorder diagnostics, and pathogenic conservative treatment were discussed.
Мочекаменная болезнь (МКБ) — хроническое заболевание, характеризующееся образованием в мочевой системе конкрементов (уролитиаз, нефролитиаз, почечнокаменная болезнь) из солевых и органических соединений мочи, возникающих на фоне обменных нарушений в организме и/или мочевой системе.
Эпидемиологические данные о распространенности МКБ варьируют в различных странах и регионах. Хотя мочекаменную болезнь обычно считают относительно редкой, в некоторых регионах мира она встречается довольно часто, например в Турции, Пакистане, ряде южноазиатских стран (1–5%, в некоторых — до 20%), странах Африки и Южной Америки. В СНГ наибольшая распространенность МКБ отмечается у жителей Центральной Азии, Северного Кавказа, Поволжья, Белоруссии, Казахстана, Алтая, Дальнего Востока. Распространенность заболевания среди детского населения значительно ниже, чем у взрослых, и по России составляет около 20 случаев на 100 тыс. населения, в то время как у взрослых — около 500–550 случаев на 100 тысяч населения. Одним из факторов, объясняющих данную ситуацию, являются особенности формирования конкрементов мочевой системы. Обменные нарушения в виде дисметаболических нефропатий начинают развиваться в детском возрасте, но преобразуются в МКБ через несколько лет, как правило, когда ребенок становится взрослым [1–5].
У взрослых мочевые камни образуются чаще у мужчин. В детском возрасте частота развития заболевания у мальчиков и девочек почти одинаковая.
Мочекаменная болезнь у детей составляет значимую часть урологической педиатрической практики. Поскольку она рецидивирует, следует приложить все усилия, чтобы выявить вызывающее ее основное метаболическое нарушение для обеспечения адекватного лечения. Большинство камней у детей расположено в верхних мочевых путях. Однако в промышленно слаборазвитых регионах мира пока еще встречаются камни в мочевом пузыре, обычно ураты аммония и мочекислые камни, что убедительно свидетельствует о роли диетических факторов [6]. В Великобритании и других европейских странах 75% камней у детей состоят из органического матрикса и струвита и во многих случаях сочетаются с инфекцией Proteus spp. и аномалиями строения мочевых путей [7].
До настоящего времени единой концепции патогенеза камнеобразования не существует. Принято считать МКБ полиэтиологичным заболеванием, связанным со сложными физико-химическими процессами, происходящими как в целом в организме, так и на уровне мочевыводящей системы, врожденного или приобретенного характера, в основе которого лежит взаимодействие генотипа и внешней среды.
Механизм образования мочевых камней сложен и происходит с участием метаболических и анатомических факторов при наличии инфекции. Основными компонентами всех камней мочевых путей являются матрикс и кристаллы (кристаллоид). Главным белком матрикса является кислый низкомолекулярный протеин, обозначаемый как вещество матрикса А. Соотношение матрикса и кристаллоида широко варьирует, что формирует как высокую организованность структуры камня, так и беспорядочное расположение кристаллоида и матрикса [5].
Первичное образование камней происходит, по-видимому, там же, где и кристаллов: предположительно в собирательных трубочках и лоханке. Развитие камней в почках протекает в два этапа: образование зародыша (ядра) и накопление вокруг него вновь образовавшихся кристаллов. Зародышеобразование, или нуклеация, происходит в результате преципитации кристаллов из перенасыщенного раствора, формирующих центр будущего камня. Дальнейший рост ядра камня происходит за счет роста собственно кристаллов ядра, агрегации новых кристаллов, а также эпитаксиального, т. е. индуцированного другими слоями, роста. В процессе нуклеации и роста камня важную роль играет растворимость ионов в моче, на которую оказывает влияние степень насыщения, ионная сила, способность к комплексообразованию, рН и скорость тока мочи. Однако значимость каждого фактора различна и зависит от состава камней. Роль перенасыщения раствора в процессе зародышеобразования кристаллов особенно велика, когда речь идет об образовании камней из фосфатов, цистина, магния, аммония, мочевой кислоты, ксантина и брушита (моногидрофосфата кальция). При оксалатно-кальциевом литиазе часто выявляется нормальная экскреция этих веществ и большую роль играет высокая ионная сила оксалатов. При этом даже при кратковременном повышении их концентрации в растворе происходит агрегация и формирование кристаллов [2, 3, 5].
По некоторым данным, в процессе нуклеации в 97% случаев играют роль нанобактерии, которые представляют собой атипичные грамотрицательные бактерии, продуцирующие карбонат кальция (апатит) на стенках клеток [8]. Нарушение оттока мочи при морфологических аномалиях может стимулировать стаз и приводить к повышению концентрации веществ, из которых образуются камни.
Кальциевые камни обычно состоят из оксалата или фосфата кальция. Основную роль в образовании камней оксалата кальция играет либо перенасыщение кальцием (гиперкальциурия) и оксалатом (гипероксалурия), либо снижение концентрации ингибиторов, например цитрата (гипоцитратурия). Гиперкальциурией называют суточную экскрецию более чем 4 мг/кг/сут кальция у ребенка весом менее 60 кг. У грудных детей младше 3 мес верхним пределом нормальной экскреции кальция считают 5 мг/кг/сут [9]. Выделяют идиопатическую и вторичную гиперкальциурию. Идиопатическую гиперкальциурию диагностируют, если при клиническом, лабораторном, рентгенологическом исследованиях выявить ее причину не удалось. Вторичная гиперкальциурия — это избыточное выведение кальция с мочой, вызванное каким-либо выявленным процессом. При вторичной (гиперкальциемической) гиперкальциурии высокий уровень кальция в сыворотке может быть обусловлен повышением резорбции костной ткани (гиперпаратиреоз, гипертиреоз, иммобилизация, ацидоз, метастазы опухолей) или избыточным всасыванием в желудочно-кишечном тракте (гипервитаминоз D) [10].
При скрининговом обследовании для выявления гиперкальциурии полезно сравнить соотношение содержания кальция и креатинина в моче. В норме соотношение кальций/креатинин 0,2, показано повторное исследование. У новорожденных и грудных детей экскреция кальция повышена, а экскреция креатинина ниже, чем у детей более старшего возраста [9, 10]. Если при динамическом наблюдении соотношения нормальны, дополнительного обследования по поводу гиперкальциурии не требуется. Однако если это соотношение остается повышенным, следует провести сбор суточной мочи и рассчитать экскрецию кальция. Проба на суточную экскрецию кальция — стандартный критерий диагностики гиперкальциурии.
Если экскреция кальция > 4 мг/кг/сут (0,1 ммоль/кг/сут), диагноз гиперкальциурии считают доказанным и проводят дополнительное обследование, в котором в сыворотке определяют содержание бикарбоната, креатинина, щелочной фосфатазы, кальция, магния, рН, содержание паратгормона. Следует также определить рН свежесобранной мочи [9–12].
Далее необходимо собрать суточную мочу для определения в ней содержания кальция, фосфора, натрия, магния, цитрата, оксалата. Одновременно следует скорригировать диету, чтобы нормализовать содержание кальция в моче [12].
Начальное лечение во всех случаях направлено на повышение потребления жидкости и увеличение диуреза. Для обеспечения эффективности лечения обязательно следует скорригировать диету. Коррекция диеты предусматривает расчет суточного уровня потребления кальция, животного белка, натрия. Рекомендуется ограничение содержания натрия в пище, а также обеспечение суточного потребления кальция в соответствии с потребностями организма ребенка [13]. Следует кратковременно назначить пробную диету с низким содержанием кальция, чтобы определить, не вносит ли потребление экзогенного кальция вклад в высокий уровень кальция в моче. Однако попытки длительного ограничения потребления кальция проводят очень осторожно (уровень доказательности 3, степень рекомендаций B). Для лечения гиперкальциурии можно назначить гидрохлортиазид и другие тиазидные диуретики в дозе 1–2 мг/кг/сут [7, 14] (уровень доказательности 3, степень рекомендаций С). Также при низких уровнях цитрата или при сохранении гиперкальциурии, несмотря на лечение, эффективно назначение цитрата [7, 15] (уровень доказательности 4, степень рекомендаций С).
Щавелевая кислота — это метаболит, выводимый почками. Только 10–15% оксалата поступает с пищей. В норме из организма детей школьного возраста выводится менее 50 мг (0,57 ммоль)/1,73 м 2 /сут этого вещества [7, 16], в то время как у грудных детей его выводится в 4 раза больше. Гипероксалурия может развиваться при избыточном приеме щавелевой кислоты с пищей, избыточном всасывании в кишечнике (например, при синдроме короткой кишки), либо вследствие врожденного нарушения обмена веществ. Первичная гипероксалурия развивается при дефиците ферментов печени, участвующих в метаболизме оксалата. При избыточном отложении оксалата кальция в почках может развиваться почечная недостаточность, что приведет к отложению оксалата кальция и в других тканях. Заболевание диагностируют по лабораторным данным — тяжелой гипероксалурии и по клиническим проявлениям. Для установления окончательного диагноза требуется биопсия печени с количественной оценкой активности ферментов. Другие формы гипероксалурии, как отмечено выше, могут быть обусловлены избыточным всасыванием оксалата при воспалительном заболевании кишечника, панкреатите, синдроме короткой кишки. Однако во многих случаях доказанного высокого уровня экскреции оксалата с мочой каких-либо нарушений обмена веществ или диетических причин у детей выявить не удается. Такую гипероксалурию называют идиопатической «мягкой», поскольку в этих случаях уровни оксалата в моче повышаются только незначительно. Для лечения гипероксалурии обеспечивают высокий диурез, ограничение поступления оксалата с пищей и регулярный прием в пищу кальция. Для снижения уровня оксалата в моче, особенно при первичной гипероксалурии, эффективен пиридоксин [7, 16] (уровень доказательности 4, степень рекомендаций С).
Цитрат — ингибитор образования камней в почках, подавляющий рост и агрегацию кристаллов оксалата кальция, а также фосфата кальция. Таким образом, низкий уровень цитрата в моче может оказаться важной причиной развития кальциевых камней. У взрослых гипоцитратурией считают экскрецию в мочу менее 320 мг/сут (1,5 ммоль/сут) цитрата; у детей это значение корригируют по размерам тела [17, 18]. Гипоцитратурия обычно развивается в отсутствие каких-либо сопутствующих симптомов или метаболических нарушений. Также она возможна при метаболическом ацидозе, дистальном канальцевом ацидозе или диарее любого генеза. Из факторов внешней среды содержание цитрата в моче снижает потребление большого количества белка и соли. Во многих публикациях подчеркивается значение гипоцитратурии при образовании кальциевых камней. У детей с кальциевыми камнями ее выявляют в 30–60% случаев. Повышение риска образования камней при гипоцитратурии стало причиной рекомендовать восстановление нормального уровня цитрата для снижения вероятности образования камней. Хотя в ряде исследований показано, что у взрослых заместительная терапия цитратом снижает риск образования камней, у детей соответствующих исследований проведено немного. Гипоцитратурию лечат назначением калия цитрата в начальной дозе 1 мэкв/кг на 2 приема [18] (уровень доказательности 3, степень рекомендаций B).
Мочекислые камни выявляют у детей в 4–8% всех случаев мочекаменной болезни. Мочевая кислота образуется при метаболизации уратов. Основной причиной появления мочекислых камней у детей оказывается гиперурикозурия. Гиперурикозурией называют выведение с мочой более 10 мг/кг/сут мочевой кислоты [7]. При семейной или идиопатической форме гиперурикозурии уровень мочевой кислоты в сыворотке детей обычно нормален. У других детей она может быть вызвана избыточной выработкой мочевой кислоты вследствие врожденных нарушений обмена веществ, миелопролиферативных заболеваний или других причин разрушения клеток. Также гиперурикозурию вызывает потребление большого количества пуринов и белка. Хотя у взрослых гиперурикозурия повышает риск образования кальциевых оксалатных камней, у детей этот фактор риска незначим. Мочекислые камни рентгенопрозрачны. Для их выявления недостаточно обзорной рентгенографии; необходима диагностика с помощью ультразвукового исследования (УЗИ) почек и спиральной компьютерной томографии (КТ).
Основной метод лечения и профилактики мочекислых камней — подщелачивание мочи, для чего особенно эффективны препараты цитрата. Для профилактики образования мочекислых камней достаточно поддерживать рН мочи на уровне от 6 до 6,5 [7].
Цистинурия вызывает образование цистиновых камней; ее выявляют в 2–6% всех случаев мочевых камней у детей. Цистинурия наследуется по неполному рецессивному аутосомному типу и проявляется невозможностью реабсорбировать 4 основные аминокислоты: цистин, орнитин, лизин, аргинин в канальцах почек. Из этих 4 аминокислот только цистин плохо растворяется в моче, поэтому при их избыточной экскреции с мочой могут образовываться только цистиновые камни. Растворимость цистина зависит от рН, и его преципитация начинается при уровне рН 7,0. Если эти методы лечения окажутся неэффективны, для снижения содержания цистина в моче и предотвращения образования камней можно назначить меркаптопропионилглицин или D-пеницилламин. Использование этих препаратов может сопровождаться тяжелыми нежелательными лекарственными реакциями, например подавлением активности костного мозга и нефротическим синдромом [19] (уровень доказательности 4, степень рекомендаций С).
Инфекционные камни составляют примерно 5% всех мочевых камней у детей. Их образование обусловлено активностью бактерий, вырабатывающих фермент уреазу (Proteus spp., Klebsiella spp., Pseudomonas spp.). Уреаза превращает мочевину в аммиак и бикарбонат, тем самым подщелачивая мочу, далее превращая бикарбонат в карбонат. В щелочной среде тройные фосфаты, постепенно образующиеся в сверхнасыщенной среде из магния аммония фосфата и карбонат-апатита, приводят к образованию камней. Для лечения кроме удаления бактерий важно также удалить камни, поскольку они стимулируют развитие инфекции, а терапия антибиотиками оказывается неэффективной. Следует рассмотреть проведение обследования для выявления каких-либо врожденных нарушений, вызывающих стаз мочи и инфекцию. К образованию камней также предрасполагают аномалии строения мочеполовой системы.
Обычно клинические проявления различаются в зависимости от возраста, причем у детей старшего возраста чаще появляются боли в поясничной области и гематурия. У детей младшего возраста чаще проявляются неспецифичные симптомы (например, возбудимость, рвота). Гематурия, обычно макрогематурия, в сочетании с болью или безболевая, у детей развивается реже. Однако микрогематурия может оказаться единственным симптомом и встречается у детей достаточно часто. В некоторых случаях единственным симптомом, на основании которого проводят рентгенологическое исследование и выявляют камни, может оказаться мочевая инфекция [20, 21].
Визуализация
В целом обследование следует начинать с УЗИ. Ультрасонография почек высокоэффективна для выявления в них камней. Во многих случаях рентгенонегативные камни удается выявить при обычном обзорном исследовании органов брюшной полости. Если камней не выявлено, но симптомы сохраняются, показано проведение спиральной КТ, которую считают наиболее чувствительным из неконтрастных методов выявления камней в мочевой системе. Исследование безопасное и быстрое, его чувствительность составляет 97%, а специфичность — 96% [22–24] (уровень доказательности 2, степень рекомендаций B). Внутривенную пиелографию у детей проводят редко, но она может потребоваться для оценки анатомии чашечек перед проведением чрескожных или полостных операций.
Исследование обмена веществ
Учитывая широкую распространенность предрасполагающих факторов к уролитиазу у детей и высокую частоту рецидивирования камней, всем детям с мочевыми камнями необходимо провести комплексное метаболическое обследование [6, 25, 26]. В рамках метаболического обследования оценивают:
- семейный и персональный анамнез метаболических заболеваний;
- анализ состава камней (после анализа состава камней метаболическое обследование можно корригировать в соответствии с их выявленным типом);
- определение уровня электролитов, азота мочевины крови, креатинина, кальция, фосфора, щелочной фосфатазы, мочевой кислоты, общего белка, карбоната, альбумина, паратгормона (при наличии гиперкальциемии);
- данные планового анализа мочи и посева мочи, в том числе с определением соотношения содержания кальция и креатинина;
- данные исследования мочи, в том числе содержание кальция, фосфора, магния, оксалатов, цитрата мочевой кислоты, цистина, белка в суточной моче, а также клиренс креатинина.
Консервативная терапия
Основы консервативной терапии МКБ такие же, как при дисметаболической нефропатии [2]. Важно устранить, по возможности, этиологический фактор и явления обструкции тока мочи.
Консервативная терапия МКБ включает использование препаратов, способствующих растворению камней (нисходящий литолизис), купированию спазма и воспаления. Для достижения успеха такая терапия должна проводиться планомерно и длительно. При этом используются комбинированные фитопрепараты (Цистон, Цистенал, Канефрон, Фитолизин и др.), которые могут применяться при любом типе уролитиаза, а также травяные сборы, смеси, спазмолитическая терапия [2, 3, 27–30].
Канефрон Н — препарат растительного происхождения, обладающий спазмолитическим, противовоспалительным, мочегонным и бактерицидным действием. Применяется в основном для профилактики камнеобразования, а также для облегчения выведения агрегатов кристаллов и мелких фрагментов конкрементов после дробления. Назначается на 6–10 недель по 1 драже или 10–25 капель 3 раза в день.
Цистон — комплексный таблетированный препарат, состоящий из экстрактов лекарственных растений, обладает диуретическим, спазмолитическим, литолитическим, противомикробным действием. Назначается при различных вариантах дисметаболических нефропатий, бессимптомной гиперурикурии, МКБ, тубулоинтерстициальном нефрите, хроническом пиелонефрите по 1–2 таблетки 2–3 раза в день соответственно возрасту на фоне диетотерапии и высокожидкостного питьевого режима. Продолжительность приема от 6 недель до 3 мес. Курсы терапии при необходимости повторяют 2–3 раза в год. Терапия Цистоном также рекомендуется пациентам с МКБ после сеансов дистанционной ударно-волновой литотрипсии. В связи с тем, что в состав препарата входит марена, Цистон следует с осторожностью назначать при гломерулонефрите, выраженной почечной недостаточности и язвенной болезни желудка. Противопоказанием к назначению Цистона является повышенная чувствительность к компонентам препарата.
Цистенал применяется как для профилактики камнеобразования, так и для купирования болевого синдрома при почечной колике. Препарат содержит: экстракт корня марены красильной, магния салицилат, эфирные масла, этиловый спирт, оливковое масло. Цистенал оказывает спазмолитическое и мягкое мочегонное действие. При почечной колике препарат применяется 3–4 раза в день по 10–20 капель за 30–40 мин до еды; с целью профилактики камнеобразования — по 2–4 капли 2–3 раза в день в течение месяца каждый квартал. При язвенной болезни желудка и двенадцатиперстной кишки Цистенал противопоказан.
Фитолизин — комплексный растительный препарат, обладающий спазмолитическим, мочегонным и противовоспалительным действием. Выпускается в форме пасты. Фитолизин способствует выведению мелких камней и «песка» из почек и мочевого пузыря и предупреждает их новое образование. Действие его обусловлено входящими в состав препарата эфирными маслами и травами (в виде водных вытяжек). Так, луковая шелуха и корень пырея, входящие в состав препарата, оказывают противомикробное действие, нормализуют обменные процессы. Плоды и лист петрушки — повышают тонус стенок мочевого пузыря, оказывают дезинфицирующее и мочегонное действие. Трава птичьего горца — обеспечивает противовоспалительное действие; трава полевого хвоща — мочегонный и кровоостанавливающий эффект; листья березы — мочегонное, противоотечное действие. Семена пажитника — обеспечивают успокаивающий эффект; трава золотарника — противомикробное и иммуностимулирующее действие; трава грыжника — противовоспалительное действие; корень любистка — дезинфицирующее действие. Эфирные масла Фитолизина (шалфейное, мятное, апельсиновое, сосновое) также оказывают мочегонное и противовоспалительное действие. Фитолизин не нарушает координацию движений и скорость психомоторной реакции пациента. Поэтому при лечении данным препаратом нет никаких ограничений в профессиональной деятельности и вождении транспортных средств. Привыкания при длительном применении Фитолизин не вызывает.
Показания к применению: препарат Фитолизин применяется для лечения инфекционных и воспалительных процессов, сопровождающих уролитиаз (мочекаменную болезнь). Также Фитолизин используется в профилактических целях для предотвращения рецидивов мочекаменной болезни.
Способ применения: взрослым и детям старше пятнадцати лет препарат Фитолизин применяют в дозировке 1 чайная ложка пасты 3–4 раза/сутки. Перед употреблением 1 чайную ложку пасты Фитолизин требуется растворить в половине стакана теплой подслащенной воды. Применять Фитолизин необходимо после приема пищи.
Продолжительность курса лечения препаратом Фитолизин составляет от 2 до 6 недель. Длительность курса определяется лечащим врачом и зависит от характера заболевания. В случае необходимости курс лечения можно повторить.
Нежелательные лекарственные реакции: при использовании препарата Фитолизин в единичных случаях у пациентов отмечалась утрата вкусовых ощущений и тошнота. Также при применении Фитолизина существует возможность появления аллергических реакций.
В случае повышенной чувствительности к ультрафиолетовому излучению у пациента может отмечаться реакция фотосенсибилизации. Если на фоне применения препарата Фитолизин отмечается развитие каких-либо необычных реакций, необходимо прекратить использование данного средства и обратиться к врачу.
Противопоказания: Фитолизин противопоказан при гиперчувствительности к составляющим препарат, при остром нефрите, сердечной недостаточности, фосфатном литиазе, нефрозе, почечной недостаточности.
Данных относительно безопасного использования препарата Фитолизин у детей младше пятнадцати лет нет, поэтому применение этого лекарственного средства в указанной возрастной группе противопоказано.
Хирургические методы лечения мочекаменной болезни
По мере развития методов лечения мочекаменной болезни от полостных хирургических вмешательств переходят к менее инвазивным эндоскопическим. Метод лечения выбирают по размеру, числу, локализации, составу камней, с учетом анатомии мочевых путей [25, 31, 32].
Таким образом, многообразие и сложность патогенетических факторов формирования мочекаменной болезни, затрагивающих как метаболические аспекты мочеобразования, воспалительные реакции, так и вопросы нарушения уродинамики на фоне аномалий развития мочевыделительной системы требуют проведения активных диагностических и лечебных действий у пациентов детского возраста, позволяющих минимизировать вероятность рецидивов образования камней, риска развития осложнений, декомпенсации почечных функций.
- Аляев Ю. Г., Рапопорт Л. М., Руденко В. И., Григорьев Н. А. Мочекаменная болезнь. Актуальные вопросы диагностики и лечения // Врачебное сословие. 2004. № 4. С. 4–9.
- Малкоч А. В. Дизметаболические нефропатии и мочекаменная болезнь // Нефрология детского возраста: Практическое руководство по детским болезням. М.: Медпрактика-М, 2005. Т. 6. С. 472–516.
- Пулатов А. Т. Уролитиаз у детей. Л.: Медицина, 1990. 208 с.
- Трапезникова М. Ф., Дутов В. В., Румянцев А. А. Современные аспекты диагностики и лечения мочекаменной болезни у детей // Врачебное сословие. 2004. № 3. С. 8–12.
- Фрейтаг Д., Хрустка К. Патофизиология нефролитиаза. В кн.: Почки и гомеостаз в норме и патологии/Под ред. С. Клара: Пер. с англ. М., 1987. С. 390–419.
- Straub M., Strohmaier W. L., Berg W., Beck B., Hoppe B., Laube N., Lahme S., Schmidt M., Hesse A., Koehrmann K. U. Diagnosis and metaphylaxis of stone disease. Consensus concept of the National Working Committee on Stone Disease for the Upcoming German Urolithiasis Guideline // World J Urol. 2005; 23 (5): 309–323. http://www.ncbi.nlm.nih.gov/pubmed/16315051.
- Bartosh S. M. Medical management of pediatric stone disease // Urol Clin North Am. 2004; 31 (3): 575–587, X–XI. http://www.ncbi.nlm.nih.gov/pubmed/15313066.
- Тареева И. Е., Кухтевич А. В. Почечнокаменная болезнь / Нефрология. М.: Медицина, 2000. С. 413–421.
- Kruse K., Kracht U., Kruse U. Reference values for urinary calcium excretion and screening for hypercalciuria in children and adolescents // Eur J Pediatr. 1984; 143 (1): 23–31. http://www.ncbi.nlm.nih.gov/pubmed/6510426.
- Sargent J. D., Stukel T. A., Kresel J., Klein R. Z. Normal values for random urinary calcium to creatinine ratios in infancy // J Pediatr. 1993; 123 (3): 393–397. http://www.ncbi.nlm.nih.gov/pubmed/8355114.
- Stapleton F. B., Noe H. N., Roy S., Jerkins G. R. Hypercalciuria in children with urolithiasis // Am J Dis Child. 1982; 136 (8): 675–678. http://www.ncbi.nlm.nih.gov/pubmed/7102617.
- Stapleton F. B., Noe H. N., Roy S., Jerkins G. R. Urinary excretion of calcium following an oral calcium loading test in healthy children // Pediatrics. 1982; 69 (5): 594–597. http://www.ncbi.nlm.nih.gov/pubmed/7079015.
- Borghi L., Schianchi T., Meschi T., Guerra A., Allegri F., Maggiore U., Novarini A. Comparison of two diets for the prevention of recurrent stones in idiopathic hypercalciuria // N Engl J Med. 2002; 346 (2): 77–84. http://www.ncbi.nlm.nih.gov/pubmed/11784873.
- Preminger G. M., Pak C. Y. Eventual attenuation of hypocalciuric response to hydrochlorothiazide in absorptive hypercalciuria // J Urol. 1987; 137 (6): 1104–1108. http://www.ncbi.nlm.nih.gov/pubmed/3586136.
- Tekin A., Tekgul S., Atsu N., Bakkaloglu M., Kendi S. Oral potassium citrate treatment for idiopathic hypocitruria in children with calcium urolithiasis // J Urol. 2002; 168 (6): 2572–2574. http://www.ncbi.nlm.nih.gov/pubmed/12441986.
- Morgenstern B. Z., Milliner D. S., Murphy M. E., Simmons P. S., Moyer T. P., Wilson D. M., Smith L. H. Urinary oxalate and glycolate excretion patterns in the first year of life: a longitudinal study // J Pediatr. 1993; 123 (2): 248–251. http://www.ncbi.nlm.nih.gov/pubmed/8345420.
- Defoor W., Asplin J., Jackson E., Jackson C., Reddy P., Sheldon C., Minevich E. Results of a prospective trial to compare normal urine supersaturation in children and adults // J Urol. 2005; 174 (4 Pt 2): 1708–1710. http://www.ncbi.nlm.nih.gov/pubmed/16148687.
- Tekin A., Tekgul S., Atsu N., Sahin A., Ozen H., Bakkaloglu M. A study of the etiology of idiopathic calcium urolithiasis in children: hypocitruria is the most important risk factor // J Urol. 2000; 164 (1): 162–165. http://www.ncbi.nlm.nih.gov/pubmed/10840454.
- Tekin A., Tekgul S., Atsu N., Sahin A., Bakkaloglu M. Cystine calculi in children: the results of a metabolic evaluation and response to medical therapy // J Urol. 2001; 165 (6 Pt 2): 2328–2330. http://www.ncbi.nlm.nih.gov/pubmed/11371943.
- Bove P., Kaplan D., Dalrymple N., Rosenfield A. T., Verga M., Anderson K., Smith R. C. Reexamining the value of hematuria testing in patients with acute flank pain // J Urol. 1999; 162 (3 Pt 1): 685–687. http://www.ncbi.nlm.nih.gov/pubmed/10458342.
- Sternberg K., Greenfield S. P., Williot P., Wan J. Pediatric stone disease: an evolving experience // J Urol. 2005; 174 (4 Pt 2): 1711–1714. http://www.ncbi.nlm.nih.gov/pubmed/16148688.
- Oner S., Oto A., Tekgul S., Koroglu M., Hascicek M., Sahin A., Akhan O. Comparison of spiral CT and US in the evaluation of paediatric urolithiasis // JBR-BTR. 2004; 87 (5): 219–223. http://www.ncbi.nlm.nih.gov/pubmed/15587558.
- Memarsadeghi M., Heinz-Peer G., Helbich T. H., Schaefer-Prokop C., Kramer G., Scharitzer M., Prokop M. Unenhanced multi-detector row CT in patients suspected of having urinary stone disease: effect of section width on diagnosis // Radiology. 2005; 235 (2): 530–536. http://www.ncbi.nlm.nih.gov/pubmed/15758192.
- Strouse P. J., Bates D. G., Bloom D. A., Goodsitt M. M. Non-contrast thin-section helical CT of urinary tract calculi in children // Pediatr Radiol. 2002; 32 (5): 326–332. http://www.ncbi.nlm.nih.gov/pubmed/11956719.
- Tiselius H. G., Ackermann D., Alken P., Buck C., Conort P., Gallucci M. Working Party on Lithiasis, European Association of Urology. Guidelines on urolithiasis // Eur Urol. 2001; 40 (4): 362–371. http://www.ncbi.nlm.nih.gov/pubmed/11713390.
- Tekin A., Tekgul S., Atsu N., Ergen A., Kendi S. Ureteropelvic junction obstruction and coexisting renal calculi in children: role of metabolic abnormalities // Urology. 2001; 5 (3), 7: 542–545. http://www.ncbi.nlm.nih.gov/pubmed/11248635.
- Тиктинский О. Л. Уролитиаз. Л.: Медицина, 1980. 191 с.
- Чистякова А. И. Фитотерапия // Лечение заболеваний почек у детей/Под ред. И. В. Марковой, М. В. Неженцева, А. В. Папаяна. СПб: СОТИС, 1994. С. 344–381.
- Эрман М. В. Мочекаменная болезнь // Нефрология детского возраста в схемах и таблицах. СПб: Специальная литература, 1997. С. 319–340.
- Юрьева Э. А., Москалева Е. С. Консервативная терапия мочекаменной болезни у детей. В кн.: Нефрология: Руководство по фармакотерапии в педиатрии и детской хирургии. М.: Медпрактика-М, 2003. Т. 3. С. 231–239.
- Raza A., Turna B., Smith G., Moussa S., Tolley D. A. Paediatric urolithiasis: 15 years of local experience with minimally invasive endourological management of paediatric calculi // J Urol. 2005; 174 (2): 682–685. http://www.ncbi.nlm.nih.gov/pubmed/16006948.
- Rizvi S. A., Naqvi S. A., Hussain Z., Hashmi A., Hussain M., Zafar M. N., Sultan S., Mehdi H. Paediatric urolithiasis: developing nation perspectives // J Urol. 2002; 168 (4 Pt 1): 1522–2625. http://www.ncbi.nlm.nih.gov/pubmed/12352448.
Т. В. Отпущенникова 1 , кандидат медицинских наук
Л. А. Дерюгина, доктор медицинских наук, профессор
ГБОУ ВПО СГМУ им. В. И. Разумовского МЗ РФ, Саратов
источник