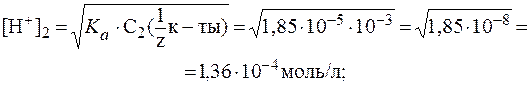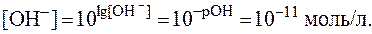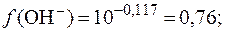Задача 542.
Во сколько раз концентрация ионов водорода в крови (рН = 7,36) больше, чем в спинномозговой жидкости (рН = 7,53)?
Решение:
а) Определим концентрацию ионов водорода в крови:
Следовательно, lg[H + ]кр = -7,36 = 8,64. По таблице логарифмов находим: [H + ] = 4,4 . 10 -8 моль/л.
б) Определим концентрацию ионов водорода в спинномозговой жидкости:
Следовательно, lg[H + ]смж = -7,53 = 8,47. По таблице логарифмов находим: [H + ] = 3 . 10 -8 моль/л.
Находим соотношение концентрации ионов водорода в крови и в спинномозговой жидкости:
Ответ: в 1,47 раза.
Задача 543.
Определить [H + ] и [OH — ] в растворе, рН которого равен 6,2.
Решение:
Определим pOH раствора из соотношения:
pH + pOH = 14;
pOH = 14 — 6,2 = 7,8.
Определим концентрацию ионов водорода:
Следовательно, lg[H + ] = -6,2 = 7,8. По таблице логарифмов находим: [H+] = 6,31 . 10 -7 моль/л.
Теперь определим концентрацию ионов [OH — ]:
Следовательно, lg[OH — ] = -7,8 = 8,2. По таблице логарифмов находим: [OH — ] = 1,6 . 10 -8 моль/л.
Ответ: [H + ] = 6,31 . 10 -7 моль/л; [OH — ] = 1,6 . 10 -8 моль/л.
Задача 544.
Вычислить рН следующих растворов слабых электролитов: а) 0,02 М NH4OH; б) 0,1 М HCN; в) 0,05 н HCOOH; г) 0,01 М CH3COOH.
Решение:
а) KD(NH4OH) = 1,8 . 10-5. Из формулы K = 2 . CM рассчитаем степень диссоциации 0,02 М раствора NH4OH:
[OH — ] = . CM = 0,03 . 0,02 = 6 . 10 -4 моль/л;
pOH = -lg[OH-] = -lg6 . 10 -4 = 4 -lg6 = 4 — 0,78 = 3,22;
pH = 14 — 3,22 = 10,78.
б) KD(HCN) = 7,9 . 10 -10 . Из формулы K = 2 . CM рассчитаем степень диссоциации 0,1 М раствора HCN:
[H + ] = . CM = 8,9 . 10 -5 . 0,1 = 8,9 . 10 -6 моль/л;
pH = -lg[H+] = -lg8,9 . 10-6 = 6 — lg8,9 = 6 — 0,95 = 5,05.
в) KD(HCООН) = 1,8 . 10 -4 . Так как муравьиная кислота одноосновная, то из формулы K = 2 . CM рассчитаем степень диссоциации 0,05 М раствора НСООН:
[H + ] = . CM = 0,06 . 0,05 = 3 . 10 -3 моль/л;
pH = -lg[H + ] = -lg3 . 10 -3 = 3 — lg3 = 3 — 0,48 = 2,52.
г) KD(СH3CООН) = 1,8 . 10 -5 . Так как муравьиная кислота одноосновная, то из формулы K = 2 . CM рассчитаем степень диссоциации 0,01 М раствора СН3СООН:
[H + ] = . CM = 4,2 . 10 -2 . 0,01 = 4,2 . 10 -4 моль/л;
pH = -lg[H + ] = -lg4,2 . 10 -4 = 4 — lg4,2 = 4 — 0,62 = 3,38.
Ответ: а) 10,78; б) 5,05; в) 2,52; г) 3,38.
источник
Примеры решения задач. Задача 1.Рассчитать концентрацию ионов водорода в растворе HCN (См = 10-3М), если a = 4,2∙10-3
Задача 1.Рассчитать концентрацию ионов водорода в растворе HCN (См = 10 -3 М), если a = 4,2∙10 -3 .
Решение:Диссоциация цианистоводородной кислоты протекает по уравнению HCN ⇄ H + + CN — ; концентрации ионов [H + ] и [CN — ] в
где n — стехиометрические коэффициенты) т.е. [H + ] = [CN — ] = a Cм, моль/л; Тогда [H + ]=[CN — ] = 4,2∙10 -3 ∙ 10 -3 = 4,2×10 -7 моль/л.
Задача 2.Рассчитать концентрацию ионов водорода и гидроксид-ионов в рстворе NH4OH, концентрацией См= 0,01М, если Кд= 1,8×10 -5 .
Решение: Гидроксид аммония диссоциирует следующим образом:
NH4OH ⇄ NH4 + + OH — константа диссоциации имеет вид Кд= ; концентрации ионов аммония [NН4 + ] и гидроксида [OH — ] совпадают (n (NH4 + ) :n (OH — ) = 1:1), обозначим их за х:
[NH4 + ] = [OH — ] = х моль/л, тогда выражение для Кд примет вид1,8×10 -5 = х 2 / 0,01-х. Считая, что х -5 =x 2 / 0,01, относительно х: х = =4,2∙10 -4 моль/л; [OH — ]= 4,2∙10 -4 моль/л.
Концентрации ионов водорода и гидроксида связаны через ионное произведение воды Кw= [H + ][OH — ] =10 -14 , выразим концентрацию ионов водорода [H + ] = Kw/[OH — ] и рассчитаем её значение [H + ]=1×10 -14 /4,2×10 -4 @ 2,3×10 -11 моль/л.
Задача 3. Определить рН раствора НСl (a=1), если См =2∙10 -3 М
Решение: Диссоциация соляной кислоты протекает по уравнению
HCl ® H + + Cl — , концентрация ионов водорода [H + ] = a Cм =1∙2∙10 -3 = 2∙10 -3 моль/л. Водородный показатель рН = — lg[H + ] = — lg2∙10 -3 = 2,7. Ответ: рН=2,7
Задача 4. Определить молярную концентрацию гидроксида аммония, если рН=11, а Кд=1,8∙10 -5 .
Решение: Концентрация ионов водорода [H + ]=10 — pH =10 -11 моль/л. Из ионного произведения воды определяем концентрацию [OH — ] = Kw/[H + ] = 10 -14 /10 -11 =10 -3 моль/л. Гидроксид аммония — слабое основание и характеризуется уравнением реакции диссоциации
NH4OH ⇄ NH4 + + OH — . Выражение для константы диссоциации
Кд=. из закона Оствальда следует, что [NH4 + ] = [OH — ] = a∙Cм, а Кд= a 2 См. Объединяя уравнения, получим См= [OH — ] 2 /Kд = 10 -6 / 1.8∙10 -5 = 0,056 моль/л
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Для студентов недели бывают четные, нечетные и зачетные. 9315 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
09. Рассчитать рН и рОН слюны, если концентрация ионов водорода в ней составляет
10. Физиологическое значение рН крови 7,36. Определить концентрацию ионов [H + ] и [OH — ] в крови.
11. Рассчитать рН раствора соляной кислоты с концентрацией 0,03 моль/дм 3 и водного раствора гидроксида калия с концентрацией 0,12 моль/дм 3 , считая, что указанные вещества диссоциируют полностью.
12. Определите рН кишечного сока, если концентрация гидроксид- анионов ОН — в составе кишечного сока составляет 2,3·10 -6 моль·дм -3 .
1. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для вузов / Ю. А. Ершов, В.А. Попков, А.С. Берлянд и др.; Под ред. Ю.А. Ершова. – 5-е изд., стер. – М.: Высш.шк., 2005. – С. 66 – 76, 101 – 107.
2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для студентов медицинских спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; Под ред. Ю.А. Ершова, В.А. Попкова. – М. : Высш. шк., 2008. – С.45-50.
Свойством всех живых организмов является постоянство рН биологических жидкостей, тканей и органов. Это постоянство поддерживается их буферными системами и необходимо для обеспечения нормальной деятельности ферментов, регулирования осмотического давления и других показателей.
Знания по теме «Буферные «системы» необходимы для понимания механизма их действия, количественной оценки способности буферных систем связывать посторонние кислоты и щелочи, понимания их взаимосвязи и роли в поддержании кислотно-основного гомеостаза.
Кроме того, важно уметь готовить буферные растворы для последующего использования их в различных медико-биологических, химических и клинических исследованиях.
Буферными называют системы, состоящие из двух сопряженных компонентов, способных до определенного предела противодействовать изменению рН среды при добавлении к ним небольших количеств кислоты и щелочи, а также при разбавлении раствора или концентрировании.
Способность буферных систем сохранять постоянство pH называется буферным действием.
По составу, с точки зрения протонной теории, буферные системы делят на кислые и основные.
Кислые буферные системы состоят из слабой кислоты и сопряженного с ней избытка сильного основания, создаваемого солью этой кислоты.
Например: Ацетатная буферная система – кислая буферная система, состоит из:

СН3СООNa – растворимая соль (содержит сопряженное сильное основание СН3СОО — ).
Аммиачная буферная система – основная буферная система, состоит из:

NН4Сl –растворимая соль (содержит сопряженную сильную кислоту NН4 + ).
Буферные системы в растворенном состоянии образуют буферные растворы.
Буферные растворы, в отличие от буферных систем, могут быть многокомпонентными.
Кровь относят к буферным растворам.
Водородный показатель среды буферного раствора рассчитывают по уравнению Гендерсона-Гассельбаха:
pH — водородный показатель среды буферного раствора,
pKa – показатель константы кислотности слабой кислоты,
[соль]/[кислота]– количества соли и кислоты в момент равновесия; буферное соотношение.— C (1/z с), C (1/z к) – исходные молярные концентрации эквивалентов соли и кислоты, моль·дм -3 ;
— V (с), V (к) – объемы растворов соли и кислоты соответственно, см 3 .
Величину, характеризующую способность буферной системы противодействовать смещению реакции среды при добавлении кислот и щелочей, называют буферной емкостью (B). Буферную ёмкость можно определить по кислоте или по основанию.
Буферная ёмкость показывает сколько моль-эквивалентов сильной кислоты или щелочи следует добавить к 1 дм 3 буферного раствора, чтобы изменить его рН на единицу.
B – буферная ёмкость, моль дм -3 ;
C(1/z кисл.; осн.) – молярная концентрация эквивалента добавляемой кислоты или основания;
V(кисл.; осн.) – объем раствора добавляемой кислоты или основания, см 3 ;
V (буф.)- объем буферного раствора, см 3 .
Для сохранения оптимальных условий обменных процессов необходимо постоянство pH внутренних сред организма. Постоянство кислотности сред, наряду с физиологическими механизмами поддерживается буферными системами организма.
Контрольные вопросы
1. Буферные системы, их состав, свойства, классификация. Механизм буферного действия. Буферные растворы
2. Уравнение кислых буферных систем Гендерсона-Гассельбаха, его вывод и анализ. Зона буферного действия.
3. Буферная емкость. Факторы, влияющие на величину буферной емкости.
4. Биологическая роль буферных систем. Буферные системы крови: гемоглобиновая, оксигемоглобиновая, белковая, водородкарбонатная, фосфатная, эфиры глюкозы и фосфорной кислоты различной степени замещенности.
5. Роль водородкарбонатной буферной системы в поддержании постоянства рН крови. Ацидоз. Алкалоз. Щелочной резерв крови.
Дата добавления: 2015-09-18 ; просмотров: 1038 . Нарушение авторских прав
источник
- A09 Тип — исследования биологических жидкостей, с помощью которых исследуются концентрации веществ в жидких средах организма и активность ферментативных систем
- A09.28 Тип — исследования биологических жидкостей. Раздел — Почки и мочевыделительная система
- A09.28.017 Определение концентрации водородных ионов (pH) мочи (Выбранный код из номенклатуры мед. услуг )
- Смежные коды:
- A09.28.002 Исследование аминокислот и метаболитов в моче
- A09.28.003 Определение белка в моче
- A09.28.004 Обнаружение миоглобина в моче
- A09.28.005 Обнаружение гемоглобина в моче
- A09.28.006 Исследование уровня креатинина в моче
- A09.28.007 Обнаружение желчных пигментов в моче
- A09.28.008 Исследование уровня порфиринов и их производных в моче
- A09.28.009 Исследование уровня мочевины в моче
- A09.28.010 Исследование уровня мочевой кислоты в моче
- A09.28.011 Исследование уровня глюкозы в моче
- A09.28.012 Исследование уровня кальция в моче
- A09.28.013 Исследование уровня калия в моче
- A09.28.014 Исследование уровня натрия в моче
- A09.28.015 Обнаружение кетоновых тел в моче
- A09.28.016 Исследование уровня лекарственных препаратов и их метаболитов в моче
- A09.28.018 Анализ минерального состава мочевых камней
- A09.28.019 Определение осмолярности мочи
- A09.28.020 Обнаружение эритроцитов (гемоглобина) в моче
- A09.28.023 Исследование уровня эстрогенов в моче
- A09.28.024 Определение гемосидерина в моче
- A09.28.025 Исследование уровня экскреции гормонов мозгового слоя надпочечников в моче
- A09.28.026 Исследование уровня фосфора в моче
- A09.28.027 Определение активности альфа-амилазы в моче
- A09.28.028 Исследование мочи на белок Бенс-Джонса
- A09.28.029 Исследование мочи на хорионический гонадотропин
- A09.28.030 Исследование парапротеинов в моче
- A09.28.031 Исследование уровня фенилаланина в моче
- A09.28.032 Исследование уровня билирубина в моче
- A09.28.033 Исследование уровня фенилпировиноградной кислоты в моче (проба Фелинга)
- A09.28.034 Исследование уровня катехоламинов в моче
- A09.28.035 Исследование уровня свободного кортизола в моче
- A09.28.036 Исследование уровня 17-гидроксикортикостероидов (17-OKC) в моче
- A09.28.037 Исследование уровня альдостерона в моче
- A09.28.038 Исследование уровня индикана в моче
- A09.28.039 Исследование уровня нитритов в моче
- A09.28.040 Исследование уровня ванилилминдальной кислоты в моче
- A09.28.041 Исследование уровня гомованилиновой кислоты в моче
- A09.28.042 Исследование уровня 5-гидроксииндолуксусной кислоты (5-ОИУК) в моче
- A09.28.043 Исследование уровня свободного и общего эстрадиола в моче
- A09.28.044 Исследование уровня свободного эстриола в моче
- A09.28.045 Исследование уровня эстрона в моче
- A09.28.046 Исследование уровня прогестерона в моче
- A09.28.047 Исследование уровня общего тестостерона в моче
- A09.28.048 Исследование уровня дегидроэпианростерона в моче
- A09.28.049 Исследование уровня дельта-аминолевуленовой кислоты (АЛК) в моче
- A09.28.052 Исследование уровня диеновых конъюгатов мочи
- A09.28.053 Исследование уровня малонового диальгида мочи
- A09.28.054 Исследование уровня антигенов переходноклеточных раков в моче
- A09.28.055 Определение психоактивных веществ в моче
- A09.28.056 Исследование уровня малонового диальдегида мочи
- A09.28.057 Исследование уровня лютеинизирующего гормона в моче
- A09.28.058 Исследование уровня C-концевых телопептидов в моче
- A09.28.059 Исследование уровня галогенпроизводных алифатических и ароматических углеводородов в моче
- A09.28.060 Исследование уровня металлов в моче
- A09.28.061 Исследование уровня свинца в моче
- A09.28.062 Исследование уровня пестицидов в моче
- A09.28.063 Исследование уровня оксипролина в моче
- A09.28.064 Исследование уровня дезоксипиридинолина в моче
- A09.28.065 Исследование уровня йода в моче
- A09.28.066 Определение N-концевого телопептида в моче
- A09.28.067 Исследование уровня хлоридов в моче
- A09.28.068 Количественное определение котинина в моче
- A09.28.069 Количественное определение этилглюкуронида в моче
- A09.28.070 Исследование уровня бора в моче
- A09.28.071 Исследование уровня алюминия в моче
- A09.28.072 Исследование уровня кремния в моче
- A09.28.073 Исследование уровня титана в моче
- A09.28.074 Исследование уровня хрома в моче
- A09.28.075 Исследование уровня марганца в моче
- A09.28.076 Исследование уровня кобальта в моче
- A09.28.077 Исследование уровня никеля в моче
- A09.28.078 Исследование уровня меди в моче
- A09.28.079 Исследование уровня цинка в моче
- A09.28.080 Исследование уровня мышьяка в моче
- A09.28.081 Исследование уровня селена в моче
- A09.28.082 Исследование уровня молибдена в моче
- A09.28.083 Исследование уровня кадмия в моче
- A09.28.084 Исследование уровня сурьмы в моче
- A09.28.085 Исследование уровня ртути в моче
- A09.28.086 Экспресс-диагностика общего, рода и видов эндотоксинов в моче
- A09.28.087 Исследование уровня антигена рака простаты 3 (PCA3) в моче
| Расшифровка кода медицинской услуги: A 09 . 28 . 017 | ||
| Класс медицинской услуги: | A | Медицинские услуги, представляющие собой определенные виды медицинских вмешательств, направленные на профилактику, диагностику и лечение заболеваний, медицинскую реабилитацию и имеющие самостоятельное законченное значение |
| Раздел медицинской услуги: | 09 | Исследования биологических жидкостей, с помощью которых исследуются концентрации веществ в жидких средах организма и активность ферментативных систем |
| Анатомо-функциоанльная область | 28 | Почки и мочевыделительная система |
| Вид медицинской услуги, имеющий законченное диагностическое или лечебное значение | 017 | Определение концентрации водородных ионов (pH) мочи |
А/B ХХ.ХХХ.ХХХ.XXX
↑ ↑ ↑ ↑ ↑
| | | | |______ порядковый номер подгруппы
| | | |______________ порядковый номер группы
| | |_______________________ подраздел медицинской услуги
| |_____________________________ раздел медицинской услуги
|___________________________________ класс медицинской услуги
Код услуги состоит из буквенно-цифрового шифра от 8 до 11 (12*) знаков.
Первый знак обозначает класс услуги, второй и третий знаки — раздел (тип медицинской услуги), четвертый и пятый (шестой*) знаки — подраздел (анатомо-функциональная область и/или перечень медицинских специальностей), с шестого по одиннадцатый знаки (с седьмого по двенадцатый*) — порядковый номер (группы, подгруппы).
3. Перечень медицинских услуг разделен на два класса: «А» и «В», построенные по иерархическому принципу (описание выше).
источник
Водородный показателем, или рН, называется взятый с обратным знаком десятичной логарифм концентрации (или активности) ионов водорода в растворе:
рН = – lg С(Н + ) или рН = – lg a (H + ).
В нейтральном растворе: С (Н + )=С (ОН — ) = 10 -7 моль/л; рН=7
В кислом растворе: С (Н + )>С (ОН — )>10 -7 моль/л; рН — )>С (Н + ) -7 моль/л; рН>7.
Вода является слабым электролитом и характеризуется ионным произведением воды, КW, которое равно:
Ионное произведение воды – величина постоянна при данной температуре. Прологарифмирую это уравнение, получим:
Из этого уравнения следует, что зная рН можно легко рассчитать рОН, и наоборот.
Расчет рН сильных электролитов
Определите рН 0,1 М раствора HCl.
Диссоциация HCl происходит полностью: HCl→H + +Cl , при этом моль/л. Соответственно , т.е. необходимо вычислить ионную силу раствора HCl и по ней в таблице выбрать коэффициент активности ионов водорода.
По таблице выбираем коэффициент активности γ, равный 0,84, следовательно:
Определите рН 0,1 М раствора NaOH.
Так как NaOH является сильным электролитом, его диссоциация происходит полностью: NaOH→Na + +OH , при этом моль/л. В данном случае рН=14–рОН и первоначально находим .
Рассчитываем ионную силу 0,1 М раствора NaOH.
.
По таблице выбираем коэффициент активности γ для ионов гидроксила, равный 0,8. Рассчитываем рОН:
Расчет рН слабых электролитов
При расчете рН слабых электролитов, обычно используют значение концентрации ионов водорода, а не величину активности , так как вследствие неполной диссоциации слабых электролитов, в растворе находится небольшое количество заряженных частиц, между которыми происходят незначительные взаимодействия. В этом случае .
Рассчитайте рН 0,1 М раствора СH3CООН, константа диссоциации которого равна КД=1,8×10 5 .
Уксусная кислота диссоциирует по уравнению:
СH3CООН→СH3CОО +H + ;
.
Так как диссоциация уксусной кислоты неполная, то , где С – исходная концентрация СH3CООН. Степень диссоциации a находим по уравнению Оствальда:
; ,
тогда =0,424×10 2 ×10 1 =0,424×10 3 ; рН=-lg0,424×10 3 =3,38.
Рассчитайте рН 0,1 М раствора NH4OH, константа диссоциации которого равна КД=1,79×10 — 5 .
Аммиак диссоциирует по уравнению
NH4ОН→N +ОH ;
рН=14–рОН;
Находим степень диссоциации a:
; .
Находим концентрацию ионов ОН и рОН раствора
=0,423×10 2 ×10 1 =0,423×10 3 ; рОН=-lg0,423×10 3 =3,38.
Контрольные задания
101*. Вычислите рН 0,05 M HCl и 0,05 М СН3СООН.
102*. Вычислите pH 0,01 M раствора NH4OH.
103*. Вычислите степень диссоциации NH4OH в 0,05 M растворе при 298 К.
104*. Вычислите рН 0,01 M NaOH и 0,01 М NH4OH.
Таблица 4. Константы диссоциации некоторых слабых электролитов
| Вещество | Кд | Вещество | Кд |
| СН3СООН | 1,7510-5 | HF | 6,6110-4 |
| NH4OH | 1,7910-5 | HCOOH | 1,7610-4 |
| HClO | 3,010-8 |
105*.Вычислите степень диссоциации и концентрацию ионов водорода [H+] в 0,3 М раствора HF.
106*. При какой молярной концентрации уксусной кислоты в растворе ее степень диссоциации равна 0,01? При какой концентрации кислоты увеличится в два раза?
107. Степень диссоциации муравьиной кислоты НСООН в 0,2 н. растворе равна 0,03. Определите константу диссоциации кислоты.
108*. Вычислите концентрацию ионов NH4+в 0,005 М растворе NH4OH при 298 К.
109*. Вычислите активности ионов Н + и ОН — в 0,01 M NaOH при 298 К.
110*. Рассчитайте молярность раствора уксусной кислоты СН3СООH, рН которого равен 3.
источник
1. Концентрация ионов водорода в растворе составляет 10 — 3 моль/л. Рассчитать значения pH, pOH и [ОН — ] в данном растворе. Определить среду раствора.
Примечание.Для вычислений используются соотношения: lg10 a = a; 10 lga = а.
1) 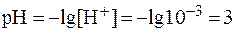
2)
3)
Среда раствора с pH = 3 является кислой, так как pH — 5 .
1) В исходном растворе слабой одноосновной кислоты СН3СООН:
2) Добавление к 10 мл раствора кислоты 90 мл воды соответ-ствует 10-кратному разбавлению раствора. Поэтому:
4. Найти значение рН раствора гидроксида кальция с молярной концентрацией эквивалента 0,002 моль/л, если 
В растворах сильных оснований:
5. рН раствора серной кислоты с молярной концентрацией 0,001 моль/л равен 2,72. Найти 
В растворе сильной кислоты:
Кислота двухосновная, следовательно, сначала необходимо определить молярную концентрацию эквивалента H2SO4 в растворе:
Зная величину pH раствора, можно рассчитать [H + ]:
6. Рассчитать рН раствора NaOH, если известно, что в 200 мл этого раствора содержится 0,0004 г NaOH ( 
В разбавленном растворе сильного основания:
Рассчитаем C( 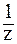
7. Вычислить число ионов гидроксида, содержащихся в 5 мл раствора, водородный показатель которого равен 3.
1)
2)
3)
Для вычисления числа ионов используется соотношение, связывающее число структурных единиц (атомов, ионов, молекул) вещества — N(x), количество этих структурных единиц — n(x) и постоянную Авогадро NА, равную 6,02·10 23 моль — 1 :
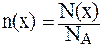
8. Рассчитать массу основания С5H5N·Н2О в 150 мл раствора, водородный показатель которого равен 10, если 
Массу основания в растворе можно вычислить, зная молярную концентрацию раствора. Так как С5H5N·Н2О — однокислотное основание, то из соотношения 14′:
рС(осн) = 2·рОН — 
Величину рОН найдем из соотношения:
С(С5H5N·Н2О) = 10 — рС = 10 — 2,8 = 1,58·10 — 3 моль/л;
9. Вычислить молярную концентрацию гидроксида калия в растворе, водородный показатель которого равен 12, если 
Гидроксид калия является однокислотным основанием, поэтому согласно соотношениям (8), (10) и (13):
10. Вычислить рН раствора азотной кислоты с C(HNO3) = 0,01 моль/л (расчет вести через активность ионов Н + ).
Для определения коэффициента активности 
Величину 
Если принять 
Для точных расчетов сотые доли имеют значение.
11. Рассчитать рН раствора, в 100 мл которого находится 0,1 г гидроксида натрия и 0,174 г сульфата калия.
Молярные концентрации электролитов в растворе составляют:
Ионная сила раствора, содержащего ионы Na + , K + , ОН — и SO4 2 — , равна:
Коэффициент активности гидроксид-ионов и их активность соответственно равны:
Из соотношения (3) находим активность ионов водорода:
12. Найти число недиссоциированных молекул кислоты в 500 мл раствора HF, если 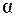

В растворе слабой одноосновной кислоты молярную концентрацию кислоты можно рассчитать по формуле (12):
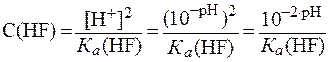
Общее количество кислоты (n) в заданном объеме раствора равно:

Количество недиссоциированной кислоты (n) найдем по формуле:

Число недиссоциированных молекул кислоты равно:
Вопросы для самоконтроля
1. Какие ионы образуются при диссоциации воды? Составьте выражение для константы диссоциации воды.
2. Что называется ионным произведением воды? Каково численное значение 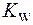
3. Чем может быть вызвано изменение величины ионного произведения воды?
4. Изменится ли ионное произведение воды при добавлении к ней кислоты, щелочи или соли?
5. Являются ли концентрации ионов Н + и ОН — в водных растворах сопряженными величинами?
6. Может ли в водном растворе кислоты (щелочи) концентрация ионов Н + или ОН — быть равной нулю?
7. Что понимают под терминами кислая, нейтральная, щелочная среда?
8. Что такое активная, потенциальная и общая кислотность в растворах кислот? Что называют активной реакцией среды?
9. Как определяют водородный и гидроксидный показатели? Какова взаимосвязь рН и рОН?
10. Что представляет собой шкала значений рН? Каковы значения рН в нейтральной, кислой и щелочной средах?
11. Имеет ли значение постоянство активной реакции среды в жизнедеятельности человека? Каковы значения рН важнейших биологических жидкостей (кровь, желудочный сок, моча, пот, слюна)?
12. Что такое ацидоз? Что такое алкалоз?
13. Какой вид имеют формулы для расчета активной кислотности в растворах сильных и слабых кислот и оснований?
14. Может ли присутствие NaCl оказать влияние на величину pH раствора соляной кислоты?
15. Могут ли величины рН и рОН принимать отрицательные значения?
Варианты задач для самостоятельного решения
1. Определить [Н + ] и [ОН — ], если рН раствора равен 4.
2. Вычислить гидроксидный показатель желудочного сока, если известно, что 100 мл его содержит 0,365 г соляной кислоты ( 
3. Рассчитать массу основания NH3×Н2О в 500 мл раствора, водородный показатель которого равен 10,5, если 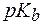
1. Вычислить число ионов Н + , находящихся в 25 мл раствора, если рОН = 14.
2. Рассчитать рН раствора гидроксида кальция с C(Са(ОH)2) = 0,02 моль/л, если 
3. Найти массу уксусной кислоты в 100 мл раствора, гидроксидный показатель которого равен 10, если 
1. Определить рН раствора и [Н + ] в растворе, если [ОН — ] = 3×10 — 5 моль/л. Указать характер среды.
2. Вычислить массу гидроксида бария в 250 мл раствора, водородный показатель которого равен 13, если 
3. Рассчитать рН раствора бензойной кислоты с молярной концентрацией 0,01 моль/л, если 
1. Вычислить рН раствора и [Н + ] в растворе, если 40 мл раствора содержат 12,04·10 20 ионов гидроксида. Указать характер среды.
2. Рассчитать рОН раствора синильной кислоты с молярной концентрацией эквивалента 0,01 моль/л, если 
3. Найти рН раствора, в 200 мл которого растворено 0,63 г азотной кислоты ( 
1. Определить [Н + ] и [ОН — ] в растворе, рОН которого равен 5.
2. Вычислить молярную концентрацию гидроксида натрия в растворе, водородный показатель которого равен 13,5, если 
3. Рассчитать величину рН раствора, в 250 мл которого находится 0,46 г муравьиной кислоты, если 
1. Рассчитать число ионов ОН — , находящихся в 2 мл раствора, если рН = 10.
2. К 100 мл раствора хлорной кислоты с C(НС1О4) = 0,1 моль/л ( 
3. Вычислить массу основания СН3NH2×Н2О в 650 мл раствора, водородный показатель которого равен 11,5, если 
1. Вычислить рОН раствора и [ОН — ] в растворе, если [Н + ] = 5×10 — 8 моль/л.
2. Рассчитать молярную концентрацию основания С2Н5NH2·H2O в растворе, водородный показатель которого равен 11,7, если 
3. Найти рН раствора гидроксида калия, если известно, что 100 мл этого раствора содержит 0,0056 г КОН. ( 
1. Определить [Н + ] и [ОН — ] в растворе, pH которого равен 6.
2. Вычислить рН раствора, в 500 мл которого находится 0,05 г LiOH. Диссоциацию щелочи считать полной. Во сколько раз изменится рН раствора при разбавлении его водой в 10 раз?
3. Найти массу азотистой кислоты, содержащейся в 800 мл раствора, гидроксидный показатель которого равен 11,4, если 
1. Определить рОН раствора, если 1250 мл раствора содержат 3,01·10 23 ионов водорода.
2. Найти рН раствора фтороводородной кислоты, если в 10 мл этого раствора растворено 0,004 г HF, а 
3. Вычислить массу гидроксида стронция в 300 мл раствора, водородный показатель которого равен 12,8, если кажущаяся степень диссоциации гидроксида равна 95%.
1. Вычислить рН раствора и [Н + ] в растворе, если [ОН — ] = 4×10 — 4 моль/л. Определить характер среды.
2. Рассчитать массу соляной кислоты, содержащейся в 1,5 мл желудочного сока, водородный показатель которого равен 1,8, если 
3. Определить водородный показатель раствора диметиламина с C((СН3)2NH×Н2О) = 0,01 моль/л, если 
1. Определить [Н + ] и [ОН — ], если рН раствора равен 1.
2. Вычислить значение рН раствора гидроксида аммония, в 450 мл которого содержится 0,07 г основания, если 
3. К 125 мл раствора серной кислоты с C(Н2SО4) = 0,03 моль/л ( 
1. Вычислить число ионов Н + , находящихся в 30 мл раствора, если рОН = 1.
2. Найти рН раствора гидроксида рубидия, если в 120 мл этого раствора содержится 0,204 г RbОН ( 
3. Определить массу пропионовой кислоты в 750 мл раствора, гидроксидный показатель которого равен 11,5, если 
1. Определить [Н + ] и [ОН — ] в растворе, рОН которого равен 4.
2. Найти рН раствора, в 400 мл которого растворено 0,256 г иодоводородной кислоты, если 
3. Рассчитать массу основания С6Н5NH2×Н2О в 1500 мл раствора, водородный показатель которого равен 9, если 
1. Определить рОН раствора и [ОН — ], если 4 мл раствора содержат 24,08·10 19 ионов водорода. Указать характер среды.
2. Вычислить молярную концентрацию бензойной кислоты в растворе, гидроксидный показатель которого равен 10,6, если 
3. Рассчитать рН раствора, содержащего гидроксид калия с С(КОН) = 0,005 моль/л и нитрат натрия с С(NаNO3) = 0,015 моль/л.
1. Вычислить [Н + ] и [ОН — ] в растворе, рОН которого равен 6,5.
2. Определить массу уксусной кислоты в 350 мл раствора, гидроксидный показатель которого равен 10,4, если 
3. К 25 мл раствора гидроксида кальция с C(Сa(OH)2) = 0,015 моль/л ( 
1. Определить число ионов ОН — , находящихся в 20 мл биологической жидкости, водородный показатель которой равен 7,35.
2. Рассчитать величину рОН раствора, в 50 мл которого находится 0,027 г бромоводородной кислоты, если 
3. Вычислить массу основания СН3NH2×Н2О в 300 мл раствора, водородный показатель которого равен 11, если 
1. Вычислить рН раствора и [Н + ] в растворе, если [ОН — ] = 2×10 — 4 моль/л. Определить характер среды.
2. Найти рН раствора, в 500 мл которого находится 0,005 моль гидроксида натрия и 0,01 моль хлорида кальция.
3. Рассчитать массу циановодородной кислоты, содержащейся в 400 мл раствора, гидроксидный показатель которого равен 11,4, если 
1. Определить соотношение [ОН — ] в крови (рН = 7,4) и в спинномозговой жидкости (рН = 7,5).
2. Найти водородный показатель раствора азотной кислоты с C(НNО3) = 10 — 9 моль/л, если 
3. Рассчитать массу основания С2Н5NH2·H2O в 1800 мл раствора, водородный показатель которого равен 11,2, если 
1. Определить рОН раствора, если 190 мл раствора содержат 15,05·10 13 ионов водорода.
2. Вычислить рН раствора гидроксида бария, если известно, что 750 мл этого раствора содержит 0,513 г Ва(ОН)2. Во сколько раз изменится рН раствора при разбавлении его водой в 20 раз? В обоих случаях диссоциацию щелочи считать полной.
3. К 10 мл раствора муравьиной кислоты с C(НСООН) = 0,15 моль/л прибавили 40 мл Н2О. Найти рОН раствора до и после разбавления, если 
1. Определить гидроксидный показатель раствора гидроксида цезия с C(CsОН) = 10 — 9 моль/л, если 
2. Рассчитать число недиссоциированных молекул слабой одноосновной кислоты в 800 мл раствора, если степень диссоциации кислоты составляет 2,5%, рН раствора равен 3,5, а 
3. Вычислить водородный показатель раствора, в 300 мл которого содержится 0,384 г иодоводородной кислоты и 0,284 г сульфата натрия.
Дата добавления: 2015-09-20 ; просмотров: 6244 | Нарушение авторских прав
источник
при решении задач на вычисление рН раствора и концентраций ионов Н + и ОН ‑
Задача 1. Вычислите рН раствора, если концентрация ионов водорода равна 7,4*10 -3 моль/л.
Решение: рН = -lg[H+ + ] = -lg(7,4*10 -3 )=(-lg7,4)+ (-lg10 -3 ) = (-0,87) + (3) = 3-0,87 = 2,13.
Задача 2. Вычислите концентрации ионов [H+ + ] и [ОН ‑ ] в растворе с
рН = 8,48.
Решение: Для нахождения концентрации ионов Н + необходимо выполнить антилогарифмирование (найти число по логарифму): рН = -lg[H + ] = 8,48;
-рН = lg[H + ] = -8,48.
Представим число (-8,48) как алгебраическую сумму целой и дробной части (характеристики и мантиссы): — 8,48 = (-8)+(-0,48). Чтобы воспользоваться таблицей логарифмов, мантиссу необходимо сделать положительной. Для этого от характеристики отнимаем единицу, а к мантиссе эту единицу прибавляем: (-8) + (-0,48) =(-9)+(0,52); меняем слагаемые местами: 0,52 + (- 9). Находим в таблице (см. приложение) мантиссу 52 (или ближайшую к ней), проводим перпендикуляры влево и вверх от нее. Число, имеющее мантиссой 52, есть 33 (3 слева, 3 вверх). Так как характеристика числа 0,52 равна 0, то в целую часть найденного числа выделяем 0 + 1 = 1 цифру и ставим запятую: 3,3. Число (-9) есть логарифм числа 10 -9 . Находим произведение полученных чисел: 3,3*10 -9 .
Ответ: [H + ] = 3,3*10 -9 моль/л; [ОН ‑ ] = = 3*10 -6 моль/л.
Задача 3. Определите концентрацию ионов ОН ‑ в растворе NН4ОН
(С = 0,01 моль/л; Кд = 1,8*10 -5 ). Рассчитайте рН этого раствора.
Решение: NН4ОН — слабый электролит и диссоциирует обратимо: NH4OH Û NH4 + + OH ‑ .
В соответствии с законом Оствальда степень диссоциации равна:
;
концентрация ионов [ОН ‑ ] == 0,01*0,042*1 = 4,2*10 -4 моль/л
рОН = — lg[ОН ‑ ] = — lg(4,2*10 -4 ) = 4 — 0,63 = 3,37; рН = 14 — 3,37 = 10,63.
Задача 4. Вычислите рН раствора NаОН (w = 0,08 %; плотность — 1 г/мл;
Ршение: Молярная концентрация раствора NаОН равна:
.
Так как степень диссоциации = 1, [ОН] = 0,02 моль/л;
рОН = — lg[ОН ‑ ] = -lg(0,02) = -lg(2*10 -2 ) = 2 — 0,3 = 1,7; рН = 14 — рОН = 14‑1,7 = 12,3.
Задача 5. Вычислите молярную концентрацию раствора муравьиной кислоты (рН = 3;
Так как рН = 3, то [Н + ] = 10 -3 ;
= = 5,5*10 -5 моль/л
Задача 6. Вычислите рН среды, константу и степень гидролиза раствора КNО2 (С = 0,05 моль/л).
Решение: КNО2 — соль слабой кислоты и сильного основания.
Для расчета рН воспользуемся формулой:
По таблице (см приложение) определяем рК азотистой кислоты:
рК = 3,4; рН = 7 + 1/2*3,4 + 1/2*lg(0,05) = 7 + 1,7 + 1/2*(-1,3)= 8,7 — 0,65 = 8,05.
Константу гидролиза определяем по формуле:
Вычисляем степень гидролиза: ,
источник
Наряду с дезинтоксикационной и водовыделительной функцией почки участвуют в регуляции КОС. Почки регулярно пополняют организм щелочными эквивалентами и выводят кислые ионы, что способствует поддержанию рН крови в стабильных пределах (у взрослого человека 7,35-7,40). Почки осуществляют это главным образом реабсорбцией бикарбонатов, секрецией водородных ионов (ацидогенез) и образованием аммиака (аммониогенез).
Бикарбонат является главным основанием плазмы крови. В то же время происходит его фильтрация клубочками почек и в клубочковом фильтрате содержится значительное количество бикарбонатов. Роль почек в регуляции КОС заключается в сохранении бикарбонатов их реабсорбцией какви проксимальных, так и дистальных отделах нефронов. По данным Г.П.Гусева (1972), в почках человека фильтруется приблизительно 4900 мэкв/сут бикарбонатов, с мочой же обычно выводится только 1—2 мэкв/сут, т.е. свыше 99,9 % профильтровавшихся бикарбонатов реабсорбируется в канальцах.
Реабсорбция бикарбонатов осуществляется благодаря способности канальцев почек (в большей степени дистальных их отделов) секретировать водородные ионы (ацидогенез). Выделяясь в просвет канальцев, водородные ионы вьтесняют щелочные элементы — катионы металлов, в частности натрия, который реабсорбируется клетками канальцев и поступает обратно в кровь в соединении с бикарбонатными нонами (НСО3) с образованием бикарбоната, чем и обеспечивается буферная система плазмы.
Процесс секреции ионов водорода тесно связан с реабсорбцией и секрецией ионов натрия, калия, кальция, магния, хлоридов, сульфатов и бикарбоната. В обмен на каждый ион водорода в кровь реабсорбируется фиксированный катион вместе с образовавшимся в клетке канальца ионом НСО3. Появление заметного количества бикарбоната в щелочной моче наблюдается во время алкалоза, после употребления бикарбоната с пищей или введения непосредственно в кровь.
Кроме того, важное значение в поддержании нормального КОС крови имеет образование в почке аммиака (аммониогенез). Образующийся в клетках проксимальных и дистальных почечных канальцев аммиак поступает в просвет канальцев, где взаимодействует с ионами водорода с образованием катиона аммония NH4. Таким образом, поступление из почечных клеток аммиака обеспечивает связывание ионов водорода и выведение анионов сильных кислот в виде солей аммония. Это способствует задержке в организме ионов калия и натрия.
В результате процессов ацидогенеза и аммониогенеза в организме сохраняются щелочные вещества и устраняется опасность ацидоза. Продукция аммиака в почках и выделение аммония с мочой зависит от КОС: во время ацидоза экскреция его с мочой значительно увеличивается, а в условиях алкалоза — уменьшается. Поэтому содержание аммиака в моче может свидетельствовать о характере и степени сдвига КОС крови в сторону ацидоза или алкалоза.
Определение аммиака в моче проводят по методу Конвея и О’Малли [Conway, O’Malley, 1942].
В основе данного метода лежит способность аммиачных солей выделять аммиак при добавлении к моче карбоната калия и последующего поглощения его кислотой. Количество кислоты, не вступившее в реакцию с аммиаком, определяют титрованием щелочью. Для получения точных результатов очень важно, чтобы исследуемая моча была свежей. При исследовании суточной мочи отдельные свежевыпущенные порции ее надо немедленно выливать в чистый сосуд, содержащий несколько кристалликов тимола, и держать в холодильнике или подкислить ее серной кислотой до рН ниже 3,0.
В суточном количестве нормальной мочи содержится 0,5—1 г аммиака. Количество аммиака в моче увеличивается при ацидозе, обусловленном диабетом, дыхательной недостаточностью, нарушением обмена веществ, дегидратации. Из всех видов ацидоза только почечный не сопровождается увеличением аммиака в моче, поскольку клетки почечных канальцев не могут вырабатывать аммиак. Выделение аммиака с мочой уменьшается при метаболических и респираторных алкалозах, почечно-тубулярных ацидозах и гипофункции коры надпочечника.
В процессе ацидогенеза в канальцах почек образуются водородные ионы, которые идут из формирование органических кислот, кислых солен и аммониевых катионов. При диссоциации в водной среде органических кислот и кислых солей освобождается некоторое количество свободных водородных ионов, содержание которых определяет истинную реакцию, или рН мочи. В зависимости от диеты и других причин рН мочи здорового человека может колебаться от 4,5 до 8,4. В норме рН мочи у взрослых и детей старшего возраста кислая или нейтральная (рН 5,0-7,0).
Реакцию (рН) мочи определяют с помощью лакмусовой бумаги, универсальной индикаторной бумаги, путем использования комбинации индикаторов и с помощью рН-метра.
Определение рН мочи при помощи лакмусовой бумаги следует проводить одновременно двумя ее видами: синей и красной. Если при этом синяя лакмусовая бумага краснеет, а красная не изменяет своего цвета, то реакция мочи кислая. Если красная лакмусовая бумага синеет, а синяя не изменяет своего цвета, реакция щелочная. Когда оба вида бумаги не меняют своего цвета, реакция нейтральная.
Более точно можно определить реакцию мочи с помощью универсальной индикаторной бумаги. Выпускаемая в нашей стране универсальная индикаторная бумага позволяет определить рН в широком диапазоне — от 1,0 до 10,0. Некоторые зарубежные фирмы выпускают специальные виды индикаторной бумаги, предназначенные для определения рН мочи в пределах 5,0-8,0.
К 2 мл утренней порции мочи добавляют 2 капли следующего реактива: 0,06 г метилового оранжевого, 0,2 г бромтимолового синего, 10 мл 0,05 н. раствора NаОН и доводят до 500 мл дистиллированной водой. После смешивания оценивают окраску:
| рН | Окраска мочи |
| 4,6 | Оранжевая |
| 5,0 | Нежно- розовая |
| 5,4 | Розовато-желтая |
| 5,8 | Желтая |
| 6,2 | Желто-зеленая |
| 6,6 | Зеленая |
| 7,0 | Зеленовато-синяя |
| 7,4 | Сине-зеленая |
Моча здоровых взрослых людей при обычном питании имеет средние значения рН 6,25±0,36 (от 5,0 до 7,0). Щелочность мочи увеличивается при употреблении большого количества овощей и фруктов, рвоте, особенно при высокой кислотности желудочного сока, ощелачивающей терапии, хронической инфекции мочевых путей, щелочном брожении мочи. Кислотность мочи увеличивается при сахарном диабете, подагре, туберкулезе почек, лихорадочных состояниях и тяжелых заболеваниях почек с нарушением функции канальцев.
Изменение рН мочи соответствует изменениям рН крови: при ацидозах моча имеет кислую реакцию, а при алкалозах — щелочную. Однако иногда наблюдается расхождение этих показателей. При хронических поражениях канальцевого аппарата почек (тубулопатиях) в крови отмечается картина гиперхлоремического ацидоза, а реакция мочи щелочная, что связано с нарушением синтеза кислоты и аммиака почечными канальцами.
При гипокалиемическом алкалозе наблюдается ацидурия. Увеличение секреции канальцами ионов водорода в ответ на недостаток калия в данной ситуации является физиологической реакцией, направленной на поддержание ионного равновесия между клетками и межтканевой жидкостью. Таким образом, определение рН мочи может иметь значение при дифференциальной диагностике алкалоза и ацидоза различной этиологии.
Более правильное представление о выделении почками водородных ионов дает определение титрационной кислотности (суммарного содержания в моче диссоциированных и недиссоциированных водородных ионов), путем титрования мочи в 0,1 н. NaOH до тех пор, пока рН мочи не достигнет величины рН плазмы крови (7,4).
Израсходованное на титрование количество щелочи делят на 10 и умножают на суточное количество мочи. Таким образом, определяют количество титруемых кислот, выделенных за сутки, в 0,1 н. раствора NaOH. У взрослых людей в норме титруемая (титрационная) кислотность составляет около 100—300 мл 0,1 н. NaOH в сутки или с учетом массы тела — от 2 до 15 мл 0,1 н. NaOH на 1 кг массы тела в сутки (0,2— 1.5 ммоль/кг/сут).
Титруемая кислота не включает аммоний, поскольку при титровании до рН 7,4 только 1 % аммония превращается в аммиак. Поэтому общее количество кислоты, выделяемое почками, определяется суммой титруемой кислоты и аммония.
Для получения наиболее достоверных и точных сведений о выделении почками водородных ионов прибегают к определению титрационной кислотности мочи вместе с аммиаком, т.е. общего количества Н+, выделенного почками. В норме у взрослых людей этот показатель равняется 40—80 ммоль/ кг/сут. Патологическим считается суммарная экскреция ионов водорода менее 125 ммоль/сут при рН мочи меньше 6,0. При сдвигах КОС в сторону ацидоза этот показатель повышается, а при метаболических алкалозах понижается.
Определить КОС в организме можно с помощью коэффициента, выраженного дробью:
Дли исследования парциальной функции компенсации метаболического ацидоза у детей применяется проба Вронга и Девиса с нагрузкой хлоридом аммония. Принцип метода заключается в том, что почки в условиях искусственно созданного метаболического ацидоза начинают усиленно экскретировать ионы водорода и аммония.
Исследование проводят в условиях стационара, на фоне стандартной диеты (содержание белка 1 — 1,5 г/кг в сутки, преимущественно растительного происхождения). Утром натощак берут кровь для определения исходных показателей КОС по содержанию стандартных бикарбонатов в крови на аппарате «микро-Аструп».
При нормальном КОС в тот же день начинают давать хлорид аммония из расчета 0,2 г/кг в сутки в течение 3 дней под контролем содержания стандартных бикарбонатов в крови до тех пор, пока оно не достигнет уровня 16—18 ммоль/л, что считают стандартными условиями для проведения пробы. На 3-й день начинают сбор суточной мочи под слой вазелина (хранят в холодильнике). Затем определяют количество титруемых кислот и аммиака, выделенных с мочой за сутки. Титруемую кислотность мочи определяют титрованием ее 0,1 н. NaOH, а содержание аммиака в моче — по методу Конвея. По окончании нагрузки вновь определяют содержание стандартных бикарбонатов в крови.
Проба Вронга и Девиса позволяет на фоне искусственного ацидоза выявить способность почек к выведению кислых валентностей. Результат оценивается положительно, если хотя бы в 1 пробе рН мочи был ниже 5,3. Учитывают суммарную экскрецию ионов водорода, представляющую собой сумму титруемых кислот и аммония.
Патологической она считается в том случае, если суммарная экскреция ионов водорода ниже 125 ммоль/сут при рН мочи ниже 6,0. Функцию аммониогенеза оценивают по аммонийному коэффициенту, представляющему собой процентное соотношение экскреции аммония к суммарной экскреции водородных ионов. В норме аммонийный коэффициент равняется 68,1—73,8 %, поскольку экскреция аммония в норме составляет 92,5—131,5 ммоль/сут, а экскреция ионов водорода с титруемыми кислотами — 32,7—56,6 ммоль/сут.
Исследование функции компенсации метаболического ацидоза имеет важное значение при заболеваниях, сопровождающихся поражением интеретициальной ткани и канальцев почки, в частности, при пиелонефрите, при котором наиболее рано и значительно нарушена функция аммониогенеза. Большое значение данная проба приобретает при раннем распознавании дистального тубулярного ацидоза, для которого характерно отсутствие снижения рН мочи в ответ на нагрузку хлоридом аммония.
источник