Иммунофиксация — это ключевой тест для подтверждения и типирования М-компонента с целью диагностики гаммапатий (миелома, болезнь Вальденстрема, лимфома, амилоидозы и пр.) при помощи антисывороток к тяжелым (G, A, M, D, E) и легким (каппа, лямбда) цепям иммуноглобулинов.
При выявлении аномальных полос на электрофореграмме сывороточных белков, в первую очередь в зонах гамма-глобулинов, а также в зонах альфа- и бета-глобулинов (эти полосы могут быть скрыты за обычными белками соответствующих зон), всегда следует заподозрить наличие моноклональных белков, т.е. гаммапатию. Для идентификации этих аномальных полос применяется методика иммунофиксации. Кроме того, иммунофиксация позволяет выявить моноклональные белки небольшой концентрации и/или скрытые другими обычными белками электрофоретического профиля.
Электрофорез с иммунофиксацией – это простая методика, которая позволяет фиксировать белок in situ после электрофореза путем образования нерастворимого комплекса с антителом к нему.
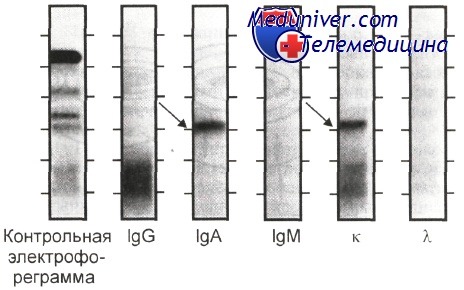
Результаты. Результат иммунофиксации сыворотки каждого пациента представлен в виде шести дорожек — одна референсная дорожка (ELP) на которой зафиксированы все белки и пяти дорожек обработанных индивидуальными антисыворотками против цепей Ig (G, А, М, каппа, лямбда или другими выбранными антисыворотками). — В первую очередь проводится оценка референсной дорожки на наличие качественных аномалий. Затем анализируются дорожки, обработанные антисыворотками. В случае присутствия в образце моноклональных Ig, выявленные на дорожках с антисыворотками полосы (одна полоса на любой из дорожек тяжелых цепей и одна на дорожка легких цепей) сравниваются с аномальными полосами на референсной дорожке – они должны иметь одинаковую скорость.
Материал для исследования: сыворотка крови или моча
Пробоподготовка: не требуется.
Совместимость с прибором
№ по каталогу
Наименование набора
Кол-во тестов на набор
Белковые фракции с иммунофиксацией ГИДРАГЕЛЬ (HYDRAGEL 1 IF (SM))
Белковые фракции с иммунофиксацией ГИДРАГЕЛЬ (HYDRAGEL 2 IF (SM))
Белковые фракции с иммунофиксацией ГИДРАГЕЛЬ (HYDRAGEL 4 IF (SM) — ACID VIOLET))
Белковые фракции с иммунофиксацией ГИДРАГЕЛЬ (HYDRAGEL 4 IF (SM) – AMIDOBLACK)
Белковые фракции с иммунофиксацией ГИДРАГЕЛЬ (HYDRAGEL 9 IF (SM))
Антисыворотки (обязательны для анализа, различные фасовки и комбинации)
Антисыворотки для иммунофиксации (IF ANTISERA AND FIXATIVE SOLUTION (SM))
Антисыворотки для иммунофиксации ANTI-Ig A (ANTI-Ig A 1 ml (SM))
Антисыворотки для иммунофиксации ANTI-Ig G (ANTI-Ig G 1 ml (SM))
Антисыворотки для иммунофиксации ANTI-Ig M (ANTI-Ig M 1 ml (SM))
Антисыворотки для иммунофиксации ANTI-KAPPA (ANTI-KAPPA 1 ml (SM))
Антисыворотки для иммунофиксации ANTI-LAMBDA (ANTI-LAMBDA 1 ml (SM))
Антисыворотки для иммунофиксации ANTI-Ig DE (ANTI-Ig DE 0,5 mL (SM))
Антисыворотки для иммунофиксации ANTI-Ig D (ANTI-Ig D 1 ml (SM))
Антисыворотки для иммунофиксации ANTI-Ig E (ANTI-Ig E 1 ml (SM))
Антисыворотки для иммунофиксации ПОЛИВАЛЕНТ (POLYVALENT 8 ml)
Антисыворотки для иммунофиксации ANTI-Ig A (ANTI-Ig A 8 ml (SM))
Антисыворотки для иммунофиксации ANTI-Ig G (ANTI-Ig G 8 ml (SM))
Антисыворотки для иммунофиксации ANTI-Ig M (ANTI-Ig M 8 ml (SM))
Антисыворотки для иммунофиксации ANTI-KAPPA (ANTI-KAPPA 8 ml (SM))
Антисыворотки для иммунофиксации ANTI-LAMBDA (ANTI-LAMBDA 8 ml (SM))
Контрольные материалы
Контрольная сыворотка для электрофореза ИФ (IF CONTROL)
Дополнительные реагенты и расходные материалы (по потребности)
Промывающий раствор для электрофореза ГИДРАЗИС (HYDRASYS WASH SOLUTION)
Обесцвечивающий раствор для электрофореза (DESTAINING SOLUTION)
Аксессуары для иммунофиксации и исследования белка Бен Джонса (для гелей форматом 1 образец на гель)
Аксессуары для иммунофиксации (для гелей форматом 2 или 4 образца на гель)
Аксессуары для иммунофиксации (для гелей форматом 9 образцов на гель)
источник
Код исследования: В69
Определение свободных легких цепей иммуноглобулинов (капа и лямбда) в сыворотке крови и в суточной моче (выявление белка Бенс-Джонса) – показатель в диагностике множественной миеломы (болезнь Рустицкого-Калера, миеломная болезнь). Основные показания к применению (c учетом клинической картины заболевания): боли в костях, патологические переломы, анемия, полинейропатия, неясные лихорадки, гиперкальциемия, протеинурия, изменения картины электрофореза белков.
Множественная миелома – это злокачественное заболевание плазматических клеток в результате их злокачественной пролиферации, происходящей главным образом в костном мозге, но иногда и в экстрамедуллярных очагах. Относится к гематоонкологическим заболеваниям. Поражаемые клетки – это плазматические клетки, являющиеся разновидностью лейкоцитов, которые вырабатывают в нашем организме иммуноглобулины (антитела). Плазматические клетки — разновидность клеток соединительной и кроветворной тканей; образуются у позвоночных животных и человека из стволовых кроветворных клеток костного мозга, являются конечным этапом развития B-лимфоцита. Основная функция – выработка антител. Каждый плазмоцит секретирует иммуноглобулины только одного класса.
Термин «миелома» впервые был предложен в 1873 году Рустицким для обозначения опухоли, развивающейся множественно в костном мозге. В 1900 г. Райт обратил внимание на связь этой болезни с поражением плазматических клеток.
Миелому обычно называют «множественной миеломой», поскольку в костях обнаруживают сразу несколько очагов или участков образования опухолей. Единичная опухоль из миеломных клеток называется изолированной плазмацитомой.
Опухолевая ткань разрастается преимущественно в плоских костях — череп, рёбра, таз и в позвоночнике, приводя к остеолизису и остеопорозу. Множественная миелома может проявляться патологическими переломами, болями в костях, анемией, снижением гемоглобина, тромбозами, кровотечениями. При разрушении костей в крови увеличивается содержания кальция , который в виде конкрементов откладывается в почках, лёгких. Миеломная нефропатия в основном обусловлена поступлением через почечный фильтр парапротеинов. Характерным для миеломной болезни является частота бактериальных инфекций вследствие уменьшения количества нормальных иммуноглобулинов и нарушения образования антител.
Иммуноглобулины разных классов (G, A, M, D, E) характеризуются общим строением. Легкие L-цепи одинаковы у всех иммуноглобулинов, тогда как тяжелые Н-цепи гетерогенны. Молекула иммуноглобулина содержит две легкие и две тяжелые цепи. Легкие цепи существуют в двух формах: каппа-цепи и лямбда-цепи.
От типа тяжелых цепей зависит принадлежность молекулы иммуноглобулина к тому или иному классу иммуноглобулинов.
Вырабатываемые пораженными клетками антитела различных видов в избыточных количествах, легкие и тяжелые цепи иммуноглобулинов принято называть парапротеинами. Их можно обнаружить в крови или в моче методом электроиммунофореза. Легкие цепи способны проходить через почечный фильтр и поэтому их находят в моче. Лёгкие цепи иммуноглобулинов, обнаруживаемые в моче или в крови называются — белок Бенс-Джонса. Белок Бенс-Джонса, примерно в 60% случаев, выявляют чаще в моче больных множественной миеломой. Чаще легкие цепи обнаруживаются в моче за счет концентрирующего эффекта и реже, в крови. Считается, что при доброкачественных парапротеинемиях белок Бенс-Джонса не выявляется, поэтому его определение используют как скрининговое исследование при подозрении на миелому.
Следует учитывать, термин — «белок Бенс-Джонса» не всегда можно отнести к наличию легких цепей. Поскольку, даже при наличии в моче легких цепей только в 10% случаев их поведение соответствует тому эффекту, который показал автор (преципитация и растворение при нагревании и охлаждении мочи). Для определения белка Бенс-Джонса применяют нагревание мочи. При 56° С белки преципитируют, а при точке близкой к кипению вновь растворяются.
По иммунохимической классификации выделяют 5 основных типов миеломы: G, A, D, Е и Бенс-Джонса (обнаруживаются только легкие цепи – «болезнь легких цепей»). К редким формам относятся несекретирующая миелома (1-3%), М-миелома, биклональная миелома (2-4%). Частота встречаемости типов миеломы примерно соответствует концентрации различных классов иммуноглобулинов в сыворотке крови: G-миелома обнаруживается в среднем в 60% случаев, А-миелома — в 25%, D-миелома — в 1%, Е- миелома 1%. М-миелома и несекретирующая форма встречаются очень редко. Чаще встречаются G- и A-миелома, миелома Бенс-Джонса (15-20%). При несекретирующей миеломе для диагностики используют определение бета-2-микроглобулина.
Легкие цепи каппа и лямбда в молекуле парапротеинов распределяются приблизительно равномерно, как и при парапротеинемии Бенс-Джонса, при D-миеломе обычно обнаруживают лямбда-цепи.
У части пациентов миеломные клетки продуцируют только легкие цепи и не продуцируют тяжелых цепей. В этом случае говорят о болезни легких цепей или миеломе Бенс-Джонса. Эти цепи обнаруживаются в моче при отсутствии патологических иммуноглобулинов в сыворотке крови. Примерно у 30% больных обнаруживаются легкие цепи в моче — легкие цепи каппа. Обнаружение белка Бенс-Джонса, типа лямбда является худшим прогностическим признаком, поскольку этот белок более нефротоксичен (приводит к развитию почечной недостаточности) чем белок каппа.
Следует учитывать, что обнаружение парапротеинов увеличивается после 50 лет и достигает 4-7 % у лиц старше 65 лет (моноклональная гаммапатия невыясненного значения). Этот термин указывает на случаи парапротеинемии без других признаков плазмаклеточного или онкогематологического заболевания.
Таким образом, при ряде заболеваний в сыворотке крови появляется большее количество какого либо из класса иммуноглобулинов (их еще называют парапротеины) на фоне присутствия и других видов иммуноглобулинов. При электрофорезе сыворотки,которая содержит нормальные иммуноглобулины, их миграция идет в виде широкой, размытой полосы, а моноклональные (парапротеины) — проявляются в виде более узкой и четко очерченной. Моноклональные иммуноглобулины в силу своей однородности мигрируют при электрофорезе с образованием четко сформированной полосы, которую называют М-градиент.
Материал: Cыворотка крови, суточная моча.
Метод: Иммунофиксации в агарозном геле.
Тест – система: HELLABIO.
Референсные значения (норма): Не обнаружено.
Основные показания к назначению анализа:
1. Диагностика миеломной болезни;
2. Макроглобулинемия Вандельстрема;
3. Амилаидоз;
4. Болезнь тяжелых цепей.
Понижение значения:
1. Свидетельствует об эффективности терапии.
источник
зарегистрируйте свою электронную почту на сайте и получайте дополнительные информационные материалы по аутоиммунной диагностике
где сдать анализ крови на тест анализы спб СПб инвитро Петербург Питер на целиакию аутоиммунные заболевания аутоантитела аутоиммунная диагностика Лапин autoimmun антиядерные лабораторная антинуклеарный фактор антинуклеарные антитела HEp-2 тип волчанка свечения амилоидоз склеродермия иммуноблот ревматоидный цитруллиновый расшифровка экстрагируемые скрининг заболевания смешанное системная СКВ артрит дсДНК CCP ССР АЦЦП саркоидоз антинейтрофильные криоглобулины гранулематозные АНФ АНЦА ANCA ENA иммунофиксация васкулиты Крона целиакия аутоиммунный печени язвенный колит глиадину трансглутаминазе стероидпродуцируюшим Вегенера яичника эндокринопатии пузырные пузырчатка пемфигоид рассеянный склероз миастения миелина белок олигоклональный изоэлектрофокусирования IgG IgA IgM легкие цепи полиневрит ганглиозидам полимиозит парапротеин миелома неоптерин островковые GAD антимитохондриальные гладкие скелетные мышцы ASCA колит антигену фосфолипидный синдром кардиолипину фосфолипидам гликопротеину нуклеосомам SSA SSB RNP Sm CENT Scl Jo-1 АМА антикератиновые антиперинуклеарный MCV LKM-1 рецептору иммунофлюоресценция ИФА иммунологическая лаборатория университет санкт-петербург павлова Чардж-Стросса полиангиит микрокристаллические первичный билиарный цирроз трансглутаминаза трансглютаминаза критерии ревматоидного артрита 2010 года СПб Питер Петербург нейрогенетика
апф, готовность исследований, цена анализа АНФ, шарко иари тута, палочки и кольца, ангиотензин превращающий фермент, янус, боррел, Нер 2 клетки гранулоциты фиксиров, циркулирующие иммунные комплексы, фактор комплемента, единицы измерения аццп, моноклональные IgM тяжелые цепи и ка, иммуноблот на боррелиоз, Шарко мари, иммуноблот печеи, антисинтетазные антитела, калиевым каналам, антифосфолипидный смндром, альфа КМ, иммунология.
Парапротеинемии и иммунофиксация
Диагностика парапротеинемий множественная миелома, болезнь легких цепей, амилоидоз, болезнь Вальденстрема, моноклональная гаммапатия неясного значения (MGUS)
Парапротеины являются первыми описанными опухолевыми маркерами, т.е. отражают объем опухоли. Как и другие онкомаркеры парапротеины встречаются как при онкологических и так и патологических процессов, отражая нарушенное функционирование иммунной системы. Наблюдается увеличение встречаемости с возрастом; в бессимптомной популяции большинство случаев представлено гаммапатии неясного значения. Значение обнаружения парапротеинемии (ПП) в популяции приведено ниже:
MGUS(без прогресса за 5 лет)
Транзиторное (пожилой возраст)
Парапротеин может быть выявлен в сыворотке крови с помощью электорофореза белков сыворотки, количественного определения основных классов иммуноглобулинов сыворотки, а также с помощью метода иммунофиксации. Несомненным преимуществом выполняемого нами метода является проведение одновременного анализа сыворотки и мочи..
Особую важность в дифференциальной диагностике злокачественных и доброкачественных состояний является обнаружение фрагментов иммуноглобулинов, которые секретируются злокачественными клетками. Фрагменты иммуноглобулинов (легкие цепи) могут быть обнаружены в моче благодаря концентрирующему эффекту, но обычно не определяются при электрофорезе белков сыворотки. Таким фрагментом иммуноглобулина является белок Бенс-Джонса (ББД), представляющий агрегаты легких цепей иммуноглобулинов. При доброкачественных парапротеинемиях ББД в моче не обнаруживается, что позволяет использовать его выявление в качестве основного метода скрининга миеломы.
Концентрации Ig сыворотки
Болезнь тяжелых цепей альфа/гамма/мю
Тест 01.02.15.340 Легкие цепи иммуноглобулинов каппа и лямбда в сыворотке крови
При миеломе легкие цепи иммуноглобулинов отражают синтез парапротеина при большинстве типов парапротеинемий. Концентрация в крови может оставаться нормальной, но обычно повышена. Целесообразно подсчитать суточную экскрецию свободных легких цепей в моче. Для каппа цепи в норме она меньше чем 0,1 гр за 24 часа.. Увеличение свидетельствует о высокой вероятности парапротеинемии и требует обследования с помощью иммунофиксации.
Тест 01.02.15.420 Скрининг парапротеинемий методом иммунофиксации с в сыворотке крови (количественная оценкая парапротеина)
Данный метод представляет разновидность иммунофиксации, при которой белки сыворотки разделяются с помощью электрофореза, а на отдельной электрофоретической дорожке проводится иммунофиксация с антисывороткой направленной против тяжелых цепей IgG, IgM, IgA и легких цепей иммуноглобулинов. При наличии подозрения на присутсвие парапротеина (моноклональной полосы) в электрофореграмме, скрининговый иммунофиксационный метод позволяет обнаружить наличие парапротеина и расчитать его количество. Благодаря низкой цене метод скрининга более удобен для обследования как в целях дифференциальной диагностики парапротеинемий, так и наблюдения за динамикой парапротеина на фоне лечения моноклональных гаммапатий.
Тест 01.02.15.640 Скрининг белка Бенс-Джонса в крови с помощью иммунофиксации (разовая и суточная моча)
Выявление белка Бенс-Джонса позволяет отличить моноклональную гаммапатию невыясненного значения и злокачественную парапротеинемию на фоне онкогематологических заболевания, с высокой вероятностью диагностирует миелому легких цепей. Позволяет оценить содержание легких цепей (и их аггрегатов) в моче.
Тест 01.02.15.650 Скрининг гаммапатий в сыворотке и моче (два материала)
Комбинированное исследование позволяет исключить диагноз парапротеинемии (и моноклональной гаммапатии) при неясной клинической картине.
Тест 01.02.15.655 Типирование парапротеина в сыворотке крови с помощью иммунофиксации (IgG, IgA, IgM, каппа, лямбда)
с количественным исследованием парапротеина
В процессе этого метода белки сыворотки и мочи одновременно разделяются с помощью электрофореза и окрашиваются соотвествующими антисыворотками. Проводится денситометриеская оценка моноклонального компонета (парапротеина) и определяется его содержанию в г/л. Вероятность множественной миеломы значительно повышается при определении парапротеина более 3 гр/л. Тест позволяет одновременно сопоставить клональность иммуноглобулинов в сыворотке и моче.
Тест 01.02.15.645 Типирование белка Бенс-Джонса с помощью иммунофиксации (разовая и суточная моча)
Исследование позволяет определить наличие и типировать белок Бенс-Джонса в моче с панелью специфических антисывороток.
источник
Уважаемые пациенты! В октябре детская медицинская сестра принимает — 10, 11, 16, 17, 19 и 26 числа.
Свободные легкие цепи иммуноглобулинов.
Анализ свободных легких цепей иммуноглобулинов (СЛЦ) в сыворотке крови – эффективный метод диагностики множественной миеломы и других парапротеинемий. Плазматические клетки синтезируют два типа СЛЦ – каппа и лямбда. СЛЦ, не вошедшие в состав моноклональных интактных иммуноглобулинов, высвобождаются в циркуляторное русло, а затем фильтруются и метаболизируются почками в зависимости от их молекулярной массы. Циркулирующие в крови СЛЦ часто формируют гомодимеры, известные как белок Бенс-Джонса – маркер множественной миеломы Бенс-Джонса.
Парапротеинемии или моноклональные гаммапатии характеризуются клональной экспансией плазматических клеток. Моноклональный иммуноглобулин, секретируемый этими клетками, является индикатором клональной пролиферации и может количественно измеряться для мониторинга течения болезни. Парапротеинемии являются преимущественно заболеваниями пожилого возраста. Несколько больших проспективных эпидемиологических исследований установили встречаемость парапротеинемии, составляющую около 1% в популяции >50 лет и 3% в популяции >70 лет.
К моноклональным парапротеинемиям с синтезом свободных легких цепей (СЛЦ) относят миелому легких цепей, первичный системный амилоидоз (AAL), болезнь отложения легких цепей и несекретирующую миелому. Часто при данных заболеваниях отсутствуют достаточно высокие концентраций сывороточных моноклональных легких цепей, поскольку они фильтруются в мочу и расщепляются эпителием проксимальных канальцев. Концентрация свободных легких цепей в этом случае очень мала, чтобы они могли быть обнаружены сывороточным электрофорезом белков или даже иммунофиксацией сыворотки крови.
Чувствительность метода иммунофиксации при AAL в сыворотке или моче составляет 70% и 90% соответственно, когда свободные легкие цепи определяются и в сыворотке и в моче. Иммунофиксация не может их определить в некоторых образцах сывороток вследствие полимеризации моноклональных легких цепей. Полимеризация части легких цепей приводит к образованию комплексов, которые разделяются при электрофорезе в очень широких аномальных пределах.
Более чувствительным подходом является иммунохимический метод с спользованием антител к свободным легким цепям иммуноглобулинов. За счет использования высокоспецифичеких антисывороток, направленных на скрытые «криптические» эпитопы легких цепей, он способен выявлять исключительно свободные каппа и лямбда легкие цепи иммуноглобулинов, но не распознает легкие цепи в составе полных молекул иммуноглобулинов, а также тяжелые цепи иммуноглобулина. Показано, что связывание антисывороток с СЛЦ более чем в 10000 раз выше по сравнению с эпитопами легких цепей в составе интактных молекул иммуноглобулина. Это преимущественное связывание позволяет определять даже малое повышение концентрации СЛЦ в присутствии поликлональных иммуноглобулинов. Хотя обнаружение СЛЦ обычно ассоциируется с моноклональными гаммапатиями и парапротеинемиями, поликлональные СЛЦ определяются в низких концентрациях в сыворотке больных воспалительными и аутоиммунными заболеваниями, а также в крови здоровых людей.
В отличие от иммунофиксации иммунохимическая оценка содержания СЛЦ является количественным измерением. Чувствительность и специфичность такого метода метода позволяет проводить количественное определение и мониторирование моноклональных легких цепей в сыворотке. Нормальные концентрации СЛЦ составляют от 3.3 до 19.4 мг/л для каппа СЛЦ и 5.7 до 26.3 мг/л для лямбда СЛЦ. Каппа/лямбда отношение в пределах от 0.26 до 1.65 является нормальным. Поскольку свободные легкие цепи подвергаются гломерулярной фильтрации, то вычисление их отношения в сыворотке диагностичеки более значимо, чем определение абсолютного уровня каждого показателя. Отношение каппа/лямбда 1.65 подтверждает продукцию каппа СЛЦ. Определение моноклональных СЛЦ представляется важным диагностическим маркером для таких разновидностей моноклональных гаммапатий как миелома с продукцией легких цепей, первичный системный амилоидоз и болезнь отложения легких цепей. Исследование каппа/лямбда коэффициентов является более чувствительным, чем метод иммунофиксации.
Несекретирующая миелома.
Свободные легкие цепи были найдены в сыворотке и моче больных с многими В-клеточными пролиферативными заболеваниями, включая множественную миелому (ММ). Иммунохимические исследования концерации СЛЦ используются для диагностики и мониторирования AL-амилоидоза, миеломы Бенс-Джонса и несекретирующей миеломы. Так, концентрация СЛЦ была измерена в сыворотке у 493 больных ММ с интактными иммуноглобулинами. Соотношение концентраций СЛЦ в крови были патологическим у 96% больных в дебюте заболевания. Концетрация СЛЦ снижалась намного быстрее при лечении основного заболевания, чем концентрации М-пика, а также отмечалась их корреляция с концентрацией бета 2-микроглобулина и числом плазматических клеток в костном мозге. Таким образом, анализ СЛЦ может быть использован для контроля за течением болезни многих больных с миеломой. В связи с коротким периодом полужизни изменения в концентрации СЛЦ позволяют обеспечить должный контроль за проводимым лечением.
В международном руководстве по анализу СЛЦ выделены три главных показания для их определения у пациентов с моноклональными гаммапатиями. В контексте скрининга парапротеинемий, сывороточный уровень СЛЦ в комбинации с электрофорезом белков и иммунофиксацией имеет высокую специфичность для моноклональных гаммапатий и исключает необходимость анализа суточной мочи. Измерение базального уровня СЛЦ имеет важное прогностическое значение для почти всех форм парапротеинемии. Анализ СЛЦ полезен для количественного монитрорирования больных с олигосекретирующими болезнями плазмацитов, включая AL-амилоидоз, олигосекретирующую миелому и почти 2/3 больных, которые ранее рассматривались как страдающие несекретирующей миеломой. При использовании иммунохимического анализа у больных с несекретирующей миеломой, у которых образцы сыворотки и мочи были негативны на наличие СЛЦ, определяемых методом иммунофиксации, исследование СЛЦ позволяет определить избыток каппа или лямбда СЛЦ у 19 из 28 пациентов. Причем количественные показатели СЛЦ коррелируют с активностью болезни, что свидетельствует о практическом значении этих исследований. Выявление нарушенного отношения каппа СЛЦ/лямбда СЛЦ подтверждает моноклональную продукцию (так называемый феномен рестрикции легкой цепи), что может наблюдаться как при миеломе с интактной продукцией иммуноглобулина, так и при миеломе с продукцией СЛЦ. У больных с продукцией моноклональных каппа цепей отношение каппа/лямбда будет повышено, и у больных с продукцией моноклональных лямбда цепей отношение каппа/лямбда будет снижено.Хотя определение СЛЦ может выделить больных с возможной моноклональной гаммапатией, заключение не должно быть окончательным ввиду значительного распространения на практике моноклональных гаммапатий невыясненного значения у пожилых лиц.
Болезнь отложения легких цепей (БОЛЦ)
Это заболевание характеризуется отложением легких цепей в базальной мембране почечных канальцев. Оно может сочетаться с плазмоклеточной дискразией, чаще всего множественной миеломой, но может наблюдаться при отсутствии гематологических расстройств и в этом случае называется идиопатической БОЛЦ. Клиническими проявлениями является почечная недостаточность и нефротическая протеинурия. Болезнь имеет крайне серьезный прогноз. Martín Herrera C et al 2008 идентифицировали 6 случаев БОЛЦ из 640 биопсий почек. Среди данных пациентов оказалось 4 женщины и 2 мужчины со средним возрастом 57 лет. У 3 из них была выявлена множественная миелома (ММ) (50%). Острая почечная недостаточность или быстро прогрессирующая почечная недостаточность оказалась наиболее частым клиническим проявлением в сочетании с нефротической протеинурией (66%). При биопсии выявлено утолщение базальных мембран канальцев с линейными отложениями каппа цепей. Наиболее частым отклонением со стороны клубочков оказалась нодулярная склерозирующая гломерулопатия (83%). Пяти из шести больным потребовался гемодиализ. Среднее время до летального исхода составило 13 недель для ММ и 110 недель для остальных больных.
Другое мультицентровое исследование БОЛЦ насчитывало 63 наблюдения. Возраст пациентов составил 58 +/- 14.2, количество мужчин в исследовании составило 63.5%, каппа/лямбда отложений в процентом отношении — 68/32%, парапротеинемии были обнаружены у 65% (ММ), лимфопролиферативные заболевания — у 3%, идиопатическая форма — у 32%. В 96% наблюдениях заболевание проявлялось только почечной недостаточностью (острой — 52%, хронической — 44%) и в 84% протеинурией более 1г/л. Во время последующего наблюдения у 36 больных развилась уремия и 37 больных умерло. Факторами, независимо ассоциированными с неблагоприятным почечным прогнозом, оказались возраст больных (RR-1.05; 95% CI — 1.009 — 1.086) и концентрация креатинина при включении (RR- 1.24; 95% CI -1.02 — 1.5). Факторами, ассоциированными с неудовлетворительным выживанием, оказались возраст, наличие MM и экстраренальное отложение СЛЦ. В то время, как отложение каппа цепей более часто сочеталось с нодулярной склерозирующей гломерулоптией, гистологические параметры поражения почек не были показатальными для определения прогноза. Таким образом, БОЛЦ следует охарактеризовать клинически как заболевание почек с протеинурией и недостаточностью их функции, которое имеет неблагоприятный прогноз.
Болезнь отложения легких цепей, как и первичный амилоидоз, часто трудны для диагностики, и присутствие моноклональных СЛЦ является важным дифференциально-диагностическим ключем этих заболеваний. Диагностика основывается на биопсии с отложением моноклональных легких цепей в пределах базальной мембраны клубочков и канальцев. В исследовании Gokden N et al (2007) среди 23 больных БОЛЦ у 21 пациента имелась ММ, у 1 выявлена другая парапротеинемия, у 1 больного причина оказалась не установлена. Нодулярная склерозирующая гломерулопатия при световой микроскопии была установлена всего в 3 случаях из 23 наблюдений. Наличие СЛЦ при иммунофлюоресценции было подтверждено во всех биопсиях. Линейные отложения легких цепей были обнаружены у 23 пациентов (100%) (18 каппа, 5 лямбда): в клубочке и канальце — у 13, только в канальцах — у 7, только в клубочке — у 1, в канальцах и интерстициуме — у 1, в клубочке, канальцах и мезангии — у 1. Электронно-микроскопические признаки в виде гранулярных электронно-плотных отложений были положительны у 15 (65%) пациентов. Только по результатам световой микроскопии поставить окончательный диагноз БОЛЦ исключительно сложно. Целесообразно использование иммунофлюоресценции и электронной микроскопии. В другой работе Gokden N et al. (2008) использовано выявление легких цепей с помощью световой, иммунофлюоресцентной и электронной микроскопии на большой группе больных. Из 46 наблюдения в 42 установлена ММ, в 2-ух имелась моноклональная гаммапатия невыясненного значения и у 2 больных не было выявлено лимфопролиферативных заболеваний. Наиболее общим проявлением заболевания при световой микроскопии оказался нодулярный гломерулосклероз, который был выявлен у 14 (30%) больных. Достоверное утолщение клубочков и канальцев было найдено у 3%, легкое и умеренное увеличение мезангиального матрикса у 12 (23%). Но у 42 пациентов выявлены иммунофлюоресцентные отложения, в том числе у 4 0(92%) больных характерное линейное отложение легких цепей (у 24 — каппа СЛЦ, у16 — лямбда СЛЦ ) вдоль базальных мембран клубочка и канальца. Среди 39 наблюдений, при которых иммунофлюоресценция и электронная микроскопия были доступны, 25 (64%) были позитивными при использовании обоих методов. Два наблюдения (6%) были негативными при использовании иммунофлюоресценции, но имелись депозиты при электронной микроскопии. У 12 больных (30%) с иммунореактивностью к легким цепям (4 — каппа СЛЦ, 8 — лямбда СЛЦ) не было обнаружено депозитов при ультраструктурном исследовании. Таким образом, световая микроскопия не позволяет поставить диагноз БОЛЦ. Иммунофлюоресцентная микроскопия более чувствительна ,чем электронно-микроскопическое исследование. Эти данные указывают на важность применения иммуногистохимических окрасок на каппа и лямбда СЦЛ методом прямой иммунофлюоресценции для диагностики БОЛЦ.
В то же время определение свободных легких цепей в крови при БОЛЦ посредством иммунохимических тестов оказалось более чем в 10 раз чувствительнее по сравнению с иммунофиксационным электрофорезом. Поскольку иммунофиксация не позволяет количественно измерять иммуноглобулины и недостаточно чувствительна для определения малых количеств моноклональных СЛЦ у всех больных с парапротеинемиями, важно подчеркнуть полезность иммунохимического измерения СЛЦ для диагностики и мониторирования болезни легких цепей. Количественное определение моноклональных СЛЦ оказалось более чувствительным, чем иммунофиксация в образцах сыворотки крови у больных БОЛЦ и пациентов с первичным системным амилоидозом. Katzmann J A et al. (2002) были разработаны референтные и диагностические интервалы для определения в сыворотке СЛЦ, который были измерены методом иммунохимического анализа, что сделало определение и номенклатуру СЛЦ более легкой и чувствительной, чем ранее применяемые методы. Они использовали автоматизированное методы выявления СЛЦ в сыворотке у 282 доноров 21-90 лет, у 47 больных моноклональными гаммапатиями и у 25 больных с поликлональной гипергаммаглобулинемией. Референтный 95% интервал для каппа СЛЦ оказался равным 3.3-19.4 мг/л и для лямбда СЛЦ — 5.7-26.3 мг/л. Референтный интервал, определенный Katzmann J A et al. (2002), близок к таковому, описанному в оригинальной работе нефелометрического определения свободных цепей (Bradwell A R et al. 2001). Диагностический интервал для каппа/лямбда отношения оказался равным 0.26-1.65. Высокая чувствительность отношения каппа/лямбда концентраций СЛЦ оказалась полезным диагностическим подходом, на который не оказывает влияния возраст пациентов.
Показано, что сывороточные концентрации каппа и лямбда цепей увеличиваются с возрастом и оказываются постоянно более высокими у лиц старшего возраста. Эта тенденция утрачивается, когда концентрация свободных цепей нормализуется по концентрации цистатина-С, который является чувствительным индикатором ренального клиренса. Повышение содержания СЛЦ с возрастом коррелирует с увеличением концентрации цистатина С. Деление результата определения СЛЦ на результат определения цистатина-С приводит к устранению соответствующей зависимости от возраста.
Отношение каппа/лямбда (K/Л) концентраций СЛЦ также не обнаруживает возрасто-зависимой тенденции. Поэтому наблюдаемое увеличение в концентрации СЛЦ в сыворотке у пожилых может быть обусловлено снижением с возрастом клиренса почек. При измерении почечного клиренса обнаруживается возрасто-зависимое уменьшение функции почек, которое начинается в третьей декаде. Увеличение значений СЛЦ, вероятно, следует приписать пониженной функции почек, а не собственно влиянию возраста. Поскольку многие пациенты с моноклональной гаммапатией имеют пониженную функцию почек и протеинурию, то это может оказаться дополнительным фактором, влияющим на интерпретацию измерений СЛЦ. Отношение K/Л, однако, не нарушается почечной дисфункцией и поэтому может надежно представлять результаты диагностического тестирования. В группе образцов от 25 больных с поликлональной гипергаммаглобулинемией значения СЛЦ были также повышены. Рост СЛЦ в этой группе пациентов, вероятно, обусловлен не пониженной функцией почек, но повышенным синтезом иммуноглобулина. Вычисление K/Л отношения в этой группе образцов также нормализовано повышение каппа и лямбда СЛЦ, так что среди них не было найдено больных с нарушенным K/Л отношением.
Таким образом, иммунохимический метод позволяет определять и квалифицировать СЛЦ у больных БОЛЦ, которые не определяются по характерному пику при электрофорезе белков сыворотки крови и в мочи.
Интересно, что те сывороточные образцы СЛЦ, которые были негативны при исследовании с помощью иммунофиксации, имели концентрации СЛЦ, которые были сходны с образцами с положительными результатами иммунофиксации. Пониженная чувствительность метода сывороточной иммунофиксации в этой группе может быть обусловлена поликлональным иммуноглобулинам, которые просто «загораживают» малые моноклональные СЛЦ полосы.
Множественная миелома.
Свободные цепи иммуноглобулина являются побочным продуктом синтеза иммуноглобулина и в здоровом организме высвобождаются в циркуляцию в малых количествах. Свободные цепи быстро удаляются ренальным клиренсом. У больных с ММ, однако, клональная пролиферация плазматических клеток может производить СЛЦ в количествах в тысячи раз больших , чем в норме. У пациентов с миеломой легких цепей или с первичным AL-амилоидозом 24-часовая экскреция легких цепей с мочей может рассматриваться как маркер массы опухоли. Однако сбор 24-часовой мочи и анализ белков представляется громозким и неточным. Был разработан чувствительной иммунохимический метод определения СЛЦ в сыворотке. Этот метод специфичен для каппа и лямбда типов СЛЦ и не распознает легкие и тяжелые цепи в составе полной молекулы иммуноглобулина. Alyanakian M A et al. (2004) проведено исследование в целях использования этого метода как индикатора аналогичного экскреции СЛЦ с мочой для наблюдения за эволюцией болезни. У 7 больных с легкоцепочечной миеломой и AL-амилоидозом были определены СЛЦ в моче, используя стандартные методы иммунофиксации. У 4 из этих больных последующее наблюдение обнаружило значительную корреляцию между уровнем СЛЦ в сыворотке и дневной экскрецией с мочей. Но отношение сывороточного уровня СЛЦ к экскреции с мочей было крайне вариабельно между пациентами . В оставшихся случаях с едва определяемыми количествами легких цепей в моче анализ сыворотки оказался достаточно чувствительным для корреляции с клинической картиной. Таким образом, иммунохимический метод СЛЦ в сыворотке может оказаться пригодным методом для последующего наблюдения за больными с легкоцепочечной секретирующей моноклональной парапротеинемией.
Эти моноклональные СЛЦ часто приводят к почечной патологии. ММ является гематологическим заболеванием, наиболее постоянно сочетающимся с острым повреждением почек, которое требует быстрой диагностики и вмешательства, чтобы избежать необратимой почечной недостаточности. Наиболее важной из них является острая цилиндровая нефропатия. Установлено, что у больных с ММ и гистологически доказанной цилиндровой нефропатией имеется менее 25% вероятности восстановления почечной функции даже при эффективно проводимой терапии основного заболевания. Присоединение этого осложнения значительно ухудшает выживание больных. Раннее восстановление почечной функции может улучшить прогноз.
Целью новейших подходов к терапии острой почечной недостаточности у больных ММ является быстрое уменьшение сывороточной концентрации СЛЦ путем эффективной химиотерапии или в комбинации с гемодиализом путем прямого удаления СЛЦ с помощью высокопроницаемых мембран. Успех, однако, зависит от раннего диагноза и вмешательства, поскольку на животных моделях было показано, что при обструкции цилиндрами уже в пределах одного месяца развивается необратимое повреждение большинства нефронов. Однако стандартные тесты для скрининга ММ, в частности электрофорез белков сыворотки и анализа мочи на белок Бенс-Джонса, часто оказываются эффективными для выявления этого грозного осложнения ММ. До появления иммунохимического исследования СЛЦ в сыворотке анализ цепей в моче представлялся предпочтительным методом для идентификации продукции моноклональных СЛЦ для рутинного гематологического скрининга ММ и других лимфопролиферативных заболеваний. Однако сбор образцов мочи в течение 24 часа у больных с почечной недостаточностью часто проблематичен. В одном таком исследовании у пациентов в дебюте ММ получить репрезентативный образец суточной мочи для исследования белока Бенс-Джонса удается менее, чем у половины пациентов. В исследовании Hutchison C A et al. (2008) образцы мочи были получены только у 24 из 41 больного с ММ.
При анализе 428 больных с моноклональными СЛЦ в моче Katzmann et al.(2006) нашли, что комбинация электрофореза белков сыворотки и сывороточного анализа СЛЦ позволяет идентифицировать всех больных, требующих лечения, и может устранить в перспективе необходимость проведения анализов мочи для скрининга белка Бенс-Джонса и электрофореза белков мочи. Анализ мочи от одного из миеломных больных был нормальным, несмотря на отчетливо повышенную концентрацию СЛЦ в сыворотке. Это исследование позволило доказать, что определение СЛЦ в сыворотке крови может быть более точным для идентификации продукции моноклональных СЛЦ по сравнению с электрофорезом мочи. Ролью сывороточного определения СЛЦ у больных с ММ с почечной недостаточностью являетс диагностика и независимый прогноз заболевания, как было продемонстировано Kyrtsonis M C et al. 2007.
Для больных с острым повреждением почек ранняя диагностика ММ может привести к раннему вмешательству и улучшить исход для пациента. Основным осложняющим фактором такого подхода является то, что больные с нарушениями функции почек могут иметь К/Л отношение СЛЦ лишь незначительно выше референтных пределов при отсутствии других доказательств присутствия моноклонального белка.
У здоровых людей в норме клиренс СЛЦ из сыворотки обеспечивается удалением их почками, что преимущественно относится к малым мономерным каппа молекулам. Это приводит к короткому периоду полужизни для каппа СЛЦ, и среднее К/Л отношение равняется примерно 0.6. Когда нарушается фильтрационная функция почек или возникает поражение проксимальных канальцев, независимо от активности ретикуло-эндотелиальной системы и костного мозга отмечается значительное нарушение клиренса СЛЦ. Это приводит к сближению периода полужизни для обоих СЛЦ, и К/Л отношение СЛЦ оказывается в большей степени зависящем от подлежащей скорости продукции легких цепей плазматическими клетками. Она приблизительно вдвое выше у каппа СЛЦ по сравнению с лямбда клетками.
источник
Протеин в моче может быть признаком серьезных осложнений со здоровьем. Почки ответственны за фильтрацию отходов и дополнительную жидкость из крови и в моче, оставляя белки в крови. Однако, когда процесс фильтрации не функционирует должным образом, организм фильтрует эти белки крови и в моче.
Различные диагностические тесты могут определять тип и количество белка в моче. Результаты теста помогут вашему врачу определить соответствующий диагноз и лечение.
Тест на иммунную фиксацию или анализ иммунофиксации мочи обнаруживает присутствие и измеряет количество определенных типов белков в мочи. Эти белки известны как иммуноглобулины. Они подразделяются на две широкие классификации: нормальные или ненормальные.
Аномальные иммуноглобулиныв моче указывают на наличие заболевания. Примером аномального иммуноглобулина является моноклональный белок или М-белок.
Тест на иммунофиксацию мочи является общим тестом, который используется, когда врач подозревает, что у человека могут быть определенные состояния здоровья, включая множественную миелому и макроглобулинемию Вальденстрема. Эти нарушения производят аномальные иммуноглобулины, которые могут быть обнаружены в моче мокрого иммунофиксационного теста.
Симптомы множественной миеломы включают:
- увеличение кровоподтеков и кровотечение десен или из носа
- усталость, бледность и одышка из-за анемии
- лихорадки неизвестного происхождения и повторные инфекции
- боль в костях, особенно в позвоночнике, ребрах, черепе и тазе
- необъяснимое повреждение кости и переломы
- симптомы высокого уровня кальция в крови, включая мышечные боли / слабость, боль в суставах, сердечные аритмии, запоры, тошнота, рвота и изменения психического состояния
Симптомы макроглобулинемии Вальденстрема включают:
- кровотечение десен
- помутнение зрения
- головокружение
- усталость
- легкие синяки кожа
- головная боль
- изменения в психическом состоянии
- онемение или покалывание в руках или ногах
- необъяснимая сыпь
Тест на иммунофиксацию мочи является общей мерой скрининга для оценки аномальных уровней иммуноглобулина, поскольку результаты доступны быстрее, чем при других тестах.
Тест иммуноэлектрофореза-сыворотки (IEP-сыворотка) дает аналогичные результаты. Это может занять больше времени, чтобы получить результаты теста IEP-сыворотки. Однако результаты могут быть более точными.
Тест на иммунофиксацию мочи происходит в условиях здравоохранения. Вам нужно будет предоставить образец мочи с чистой водой.Этот метод поможет предотвратить появление микробов, находящихся вблизи или в уретре, от входа в контейнер для проб.
Ваш врач или медсестра предоставят вам набор для очистки мочи. В комплект входят стерильные полотенца для чистки и контейнер с стерильным лотком с крышкой. Если вы мужчина, вы должны сначала очистить голову пениса, используя стерильные полотенца. Если вы женщина, используйте стерильные полотенца, чтобы вымыть область между губами вульвы.
После тщательной очистки, вы будете мочиться небольшим количеством в унитаз, а затем остановите поток мочи. Это очистит уретру от загрязнений. Затем вы будете собирать оставшуюся мочу в стерильной чашке. Общий объем образца мочи должен составлять от одной до двух унций.
Когда вы закончите сбор образца, вы положите крышку на чашку и оставите ее в коробке, помеченной для образцов, или отведите ее к врачу или медсестре. Человек, который дал вам комплект для чистки, расскажет вам, что делать с образцом. Затем врач или медсестра отправят образец мочи в лабораторию для оценки.
Процедура мочи с чистым улоком может быть неудобной, и вы можете обнаружить, что ваш первый образец меньше требуемой от одной до двух унций. Это не редкость. Вы можете выполнить более одной процедуры очистки, чтобы получить необходимый объем выборки.
Вы должны попросить новый стерильный набор для чистки для каждой попытки сбора мочи. Вы не можете повторно использовать стерильные полотенца и контейнеры. Повторите все шаги процедуры мочи с чистым улоком, когда вы собираете больше мочи.
Тест на иммунофиксацию мочи требует только нормального мочеиспускания. Тест не является инвазивным и не представляет значительных рисков для пациента. Тест не должен вызывать дискомфорта.
Отрицательный результат теста показывает, что в моче нет аномальных иммуноглобулинов. Если тест не обнаруживает аномальные иммуноглобулины, вам может не потребоваться дополнительное тестирование.
Положительный результат означает, что аномальные иммуноглобулины присутствуют в моче. Аномальные иммуноглобулины могут указывать на серьезную проблему со здоровьем, такую как множественная миелома или макроглобулинемия Вальденстрема. Наличие аномальных иммуноглобулинов также может быть признаком других видов рака.
Тест на мочи иммунофиксации является лишь одним из нескольких диагностических тестов, которые подтвердят ваш диагноз. Обнаружение аномальных иммуноглобулинов может не указывать на основное состояние здоровья некоторых пациентов. Небольшой процент людей имеет низкий уровень аномальных иммуноглобулинов в их телах. Эти люди не развивают никаких проблем со здоровьем. Это состояние известно как моноклональная гаммапатия неизвестного значения (MGUS).
источник
Выявление в моче свободных легких цепей иммуноглобулинов (белка Бенс-Джонса), используемое для диагностики моноклональных гаммапатий, в том числе множественной миеломы.
Свободные легкие цепи иммуноглобулинов в моче
Синонимы английские
Bence-Jones protein, Urine (immunofixation)
Какой биоматериал можно использовать для исследования?
Суточную мочу, среднюю порцию утренней мочи.
Общая информация об исследовании
Белок Бенс-Джонса – это группа моноклональных свободных легких цепей иммуноглобулинов, которые могут быть определены в моче или в крови. Их появление характерно для лимфопролиферативных заболеваний, таких как множественная миелома. Эта особенность была впервые описана английским врачом Генри Бенс-Джонсом при исследовании образца мочи, что и дало такое название. Впоследствии стало известно, что белок Бенс-Джонса – это, в действительности, гомогенная группа свободных легких цепей иммуноглобулинов, синтезируемых одной плазматической клеткой (моноклональных). Белок Бенс-Джонса – это собирательное название мономеров, димеров, тетрамеров и других полимерных структур, состоящих из легких цепей иммуноглобулинов.
Свободные цепи иммуноглобулинов – это полипептиды с молекулярной массой 22 кДа, которые синтезируются плазматическими клетками и, соединяясь с тяжелыми цепями, образуют молекулы иммуноглобулинов различных классов: IgG, IgM, IgA и других. В зависимости от строения константного домена, различают два класса легких цепей – лямбда (λ) и каппа (κ) цепи. Каждый иммуноглобулин может иметь только один класс легких цепей – или лямбда, или каппа. В норме плазматические клетки синтезируют больше легких, чем тяжелых цепей. Легкие цепи, не вошедшие в состав иммуноглобулинов, называются свободными. Свободные каппа-цепи, как правило, существуют в виде мономера, имеют небольшой размер и поэтому относительно легко фильтруются в первичную мочу. Лямбда-цепи, напротив, обычно существуют в форме димера, что затрудняет их фильтрацию в почечных клубочках. В редких случаях как каппа-, так и лямбда-цепи могут образовывать тетрамеры – крупные комплексы белков, которые в мочу не проникают. В норме практически все количество легких цепей, поступивших в почечные канальцы, подвергается реабсорбции и лишь их незначительная часть выделяется с мочой (не более 0,75-1,8 мг/л). Появление избытка свободных легких цепей иммуноглобулинов в моче (появление белка Бенс-Джонса) может свидетельствовать об их чрезмерной продукции плазматическими клетками (гаммапатии) или о нарушении процесса почечной реабсорбции (заболевания почек). Обнаружение белка Бенс-Джонса может быть использовано для диагностики и контроля лечения этих заболеваний.
Белок Бенс-Джонса определяется у 50-70 % пациентов с множественной миеломой, 30-40 % пациентов с макроглобулинемией Вальденстрема и у 90 % пациентов с первичным амилоидозом. Другими состояниями, при которых может наблюдаться белок Бенс-Джонса в моче, являются лимфома, лейкоз (чаще хронический лимфолейкоз или плазмаклеточный лейкоз), рак поджелудочной железы, медуллярная карцинома щитовидной железы, доброкачественная гаммапатия неясного генеза. При отсутствии какой либо причины появления этого белка в моче говорят об идиопатической протеинурии Бенс-Джонса.
Свободные легкие цепи иммуноглобулинов не могут быть определены с помощью обычного анализа мочи – для этого используются специальные тесты. Как правило, лабораторная диагностика при подозрении на гаммапатию начинается с обычного электрофореза белков плазмы и мочи. Этот шаг необходим для определения концентрации М-белка (парапротеина) и начальной дифференциальной диагностики гаммапатий. Электрофорез, однако, недостаточно чувствительный метод. По этой причине на втором этапе обследования рекомендуется проведение более чувствительного теста – иммунофиксации белков мочи. Это позволяет избежать диагностических ошибок, учитывая, что гаммапатии могут иметь нормальный результат электрофореза белков. Метод иммунофиксации позволяет не только выявить даже незначительное количество свободных легких цепей, но и определить их класс (лямбда-или каппа-цепи).
Как правило, проводят параллельный анализ как крови, так и мочи. Это связано с некоторыми особенностями экскреции легких цепей при гаммапатиях. Например, у большинства пациентов с клиническими признаками миеломы при электрофорезе сыворотки обнаруживается более 3 г М-белка в дл крови. Однако примерно у 20 % пациентов выявляется лишь незначительное повышение М-белка (менее 1 г в дл крови) или вовсе нормальный уровень иммуноглобулинов крови. При анализе мочи у таких пациентов удается выявить повышенную экскрецию легких цепей в мочу (такая миелома часто называется миеломой Бенс-Джонса). Таким образом, параллельный анализ позволяет предотвратить ошибки диагностики.
Следует отметить, что существует особая, редкая форма миеломы, при которой легкие цепи не выявляются ни в крови, ни в моче ни с помощью электрофореза, ни иммунофиксации (так называемая несекретирующая множественная миелома). Для диагностики этой формы миеломы рекомендуется определение соотношения свободных легких цепей иммуноглобулинов λ и κ в сыворотке крови.
Белок Бенс-Джонса также может не определяться в моче на ранней стадии заболевания, когда избыток свободных легких цепей еще может быть реабсорбирован в почечных канальцах (вплоть до 1 г в день при нормальной функции почек), и в редких случаях, когда свободные легкие цепи образуют тетрамеры, не фильтрующиеся в почечном клубочке.
Ложноположительный результат может быть получен при приеме некоторых лекарственных средств (например, аспирин и пенициллин в высоких дозах), хронической почечной недостаточности или при некоторых системных заболеваниях (ревматоидный артрит, СКВ, полимиозит).
Учитывая эти ограничения метода иммунофиксации, интерпретация результатов должна проводиться с учетом дополнительных анамнестических, лабораторных и инструментальных данных.
Для чего используется исследование?
- Для диагностики и контроля лечения моноклональных гаммапатий (множественной миеломы, болезни легких цепей, макроглобулинемии Вальденстрема).
Когда назначается исследование?
- При подозрении на множественную миелому и другие заболевания из группы моноклональных гаммапатий (множественной миеломы, болезни легких цепей, макроглобулинемии Вальденстрема).
Парапротеина, представленного каппа/лямбда легкими цепями — не обнаружено.
- первичный амилоидоз;
- моноклональная гаммапатия неясного генеза;
- криоглобулинемия;
- синдром Фанкони;
- гиперпаратиреоз;
- множественная миелома;
- остеомаляция;
- макроглобулинемия Вальденстрема;
- медуллярный рак щитовидной железы;
- аденокарцинома поджелудочной железы;
- лимфома;
- лейкоз;
- идиопатическая протеинурия Бенс-Джонса.
- норма;
- эффективное лечение заболевания.
Что может влиять на результат?
- Стадия заболевания: белок Бенс-Джонса может не определяться в моче на ранней стадии заболевания;
- прием аспирина и пенициллина в высоких дозах может приводить к получению ложноположительного результата;
- наличие системных заболеваний (ревматоидный артрит, СКВ, полимиозит) и хронической почечной недостаточности может приводить к получению ложноположительного результата;
- наличие тетрамеров лямбда- или каппа-легких цепей (не попадающих в мочу) может приводить к получению ложноотрицательного результата.
- Рекомендуется проводить иммунофиксацию белков как мочи, так и крови;
- интерпретацию результатов следует проводить с учетом дополнительных анамнестических, лабораторных и инструментальных данных.
Кто назначает исследование?
Гематолог, онколог, терапевт, врач общей практики.
- NauKC, LewisWD. Multiplemyeloma: diagnosisandtreatment. Am Fam Physician. 2008 Oct 1;78(7):853-9. Review.
- Levinson SS, Keren DF. Free light chains of immunoglobulins: clinical laboratory analysis. Clin Chem. 1994 Oct;40(10):1869-78.
- Whicher JT, Hawkins L, Higginson J. Clinical applications of immunofixation: a more sensitive technique for the detection of Bence Jones protein. J Clin Pathol. 1980 Aug;33(8):779-80.
- Chernecky C. C. Laboratory Tests and Diagnostic Procedures / С.С. Chernecky, В.J. Berger; 5th ed. — Saunder Elsevier, 2008.
источник
Иммунохимически идентифицировать белки на электрофореграмме без потери наглядности и четкости классической электрофоретической картины позволяет метод иммунофиксации (ИФ).
При выполнении иммунофиксации на одной и той же пластине с агарозным гелем проводят несколько электрофоретических разделений исследуемого образца, после чего один из треков окрашивают сразу после окончания фореза (он служит контролем), а на поверхность остальных наносят антисыворотки определенной специфичности.
В месте расположения белка, прореагировавшего с родственной ему антисывороткой, через некоторое время (обычно в пределах часа) образуется преципитат, который полностью сохраняет форму и положение изучаемой фракции. Предварительно отмыв несвязавшиеся белки солевым раствором, пластины окрашивают. Зону миграции белка уточняют, соотнося положение преципитата, образованного этим белком, с контрольной фореграммой.
Иммунофиксацию широко используют в диагностике моноклональной секреции. К наиболее типичным ситуациям относятся:
1) иммунохимическая идентификация небольших М-градиентов, особенно при нормальном содержании поликлональных иммуноглобулинов;
2) выявление и идентификация скрытых М-градиентов, когда моноклональный белок мигрирует в зоне а- или b-глобулинов и маскируется нормальными белками этих фракций, особенно при низком уровне продукции.
В ряде случаев иммунофиксация позволяет распознать так называемые ложные М-градиенты — электрофоретически гомогенные полосы, напоминающие М-градиент, но не относящиеся к иммуноглобулинам. Отсутствие специфического преципитата в зоне такой полосы при реакции с антисыворотками к Н- и L-цепям иммуноглобулинов позволяет отвергнуть предположение о наличии парапротеина в исследуемом образце.
При проявлении электрофореграмм антисыворотками к а- и к-цепям иммуноглобулинов в b2-зоне выявлен М-градиент, образованный парапротеином Ак (указан стрелкой).
Иммунофиксация является методом выбора при анализе множественной секреции, если в образце присутствуют два и более М-градиентов.
Помимо высокой специфичности и разрешающей способности, достоинством метода является также его высокая чувствительность. Это объясняется двумя факторами: накоплением белка (антител) в зоне градиента при образовании специфического преципитата и минимальной диффузией антигена при реакции с антисывороткой. При иммунофиксации можно выявить следовые М-градиенты, которые не видны на окрашенной электрофореграмме.
Основная методическая трудность — подбор адекватного разведения образца для получения плотного, хорошо видимого преципитата. Если образец разведен недостаточно, то преципитат может раствориться в избытке антигена (исследуемый белок). При слишком большом разведении образца образовавшийся преципитат можно не увидеть. В обоих случаях имеет место ложноотрицательный результат.
В последние годы благодаря исключительно высокой информативности метода и появлению коммерческих диагностических наборов, укомплектованных высокоаффинными антисыворотками (что приводит к получению стабильных результатов), иммунофиксация в большинстве диагностических ситуаций оттеснила на второй план традиционный иммуноэлектрофорез (ИЭФ).
Чувствительность иммунофиксации можно значительно повысить, если использовать для разделения белков противоточный изотахофорез (ИТФ) на ацетат-целлюлозной мембране, предложенной Г. И. Абелевым и соавт.. Это метод электрофореза в неоднородной системе буферов, имеющих общий катион, но разные анионы.
При изотахофорезе (ИТФ) ионы разделяемого образца располагаются в порядке уменьшающейся электрофоретической подвижности между двумя видами анионов буфера: «ведущим» (с более высокой подвижностью) и «замыкающим» (с меньшей подвижностью). Изотахофорез (ИТФ) позволяет одновременно с разделением концентрировать в 10—100 раз белки, находящиеся в высокоразбавленных растворах.
В связи с этим метод хорошо подходит для выявления и индентификации белка Бенс-Джонса в моче, а также для исследования малобелковых биологических жидкостей, доступных в небольшом объеме, ограничивающем предварительное концентрирование (церебральная и слезная жидкости, слюна и т. д.).
источник
В нашей клинике у пациентов с диагнозом множественная миелома или с подозрением на множественную миелому есть возможность на современном уровне получить полную лабораторную диагностику и/или мониторинг ММ.
Лабораторные методы диагностики Множественной Миеломы:
- Иммунофенотипирование плазматических клеток костного мозга.
- Соотношение свободных каппа/лямбда цепей в сыворотке крови.
- Соотношение свободных каппа/лямбда цепей в моче.
- Определение уровня бета2-микроглобулина в сыворотке крови.
- Исследование уровня парапротеинов в крови.
- Исследование моноклональности в крови методом иммунофиксации
- Исследование моноклональности в моче методом иммунофиксации
Множественная миелома (ММ) – вторая по распространенности гематологическая опухоль, ее частота составляет 1% от всех злокачественных опухолей и 10% от всех гемобластозов. Заболевают ММ преимущественно пожилые люди (медиана возраста на момент установления диагноза – около 70 лет), лишь 5–10% пациентов моложе 40 лет. Распространенность в Европе и Америке по сведениям различных зарубежных авторов, колеблется от 3-5 до 7,5 случаев на 100 000 человек. При этом число заболевших увеличивается в старшей возрастной категории населения, достигая 20/100000 человек в год в возрасте 70–79 лет.
Субстратом опухоли при множественной миеломе являются плазматические клетки, продуцирующие моноклональный иммуноглобулин. Плазмоклеточная инфильтрация выявляется при исследовании костного мозга, при биопсии костей и мягких тканей. Поражение костного мозга может носить как очаговый, так и диффузный характер. При цитологическом исследовании костного мозга не представляется возможным определить какие-либо специфические отличия миеломных клеток от нормальных плазматических.
В нашей клинике мы проводим диагностику плазматических клеток в костном мозге пациента методом проточной цитометрии. Методом проточной цитометрии возможно отличить нормальные плазматические клетки от патологических. Метод проточной цитометрии в настоящее время является самым точным и быстрым в диагностике патологических плазматических клеток при множественной миеломе.
Бета2-микроглобулин
Бета2-микроглобулин – это протеин, являющийся структурной частью антигена HLA 1-го класса. HLA – антигены, специфичные для каждого отдельного человека, являются поверхностными белками всех ядросодержащих клеток организма.
Наибольшее количество бета2-микроглобулина находится на поверхности лимфоцитов крови, поэтому его вполне успешно применяют в качестве маркера лимфопролиферативных патологий кровеносной системы (в частности множественной миеломы). Его количество будет прямо пропорционально массе опухолевой ткани, то есть увеличение показателя в динамике будет свидетельствовать о прогрессировании болезни. И наоборот, данный онкомаркер можно использовать для контроля эффективности лечения рака крови – при отсутствии снижения его уровня лекарственный препарат считается неэффективным и заменяется другим.
Обнаружение свободных цепей
Циркулирующие в сыворотке крови свободные цепи иммуноглобулинов являются естественным продуктом В-лимфоцитов и представляют собой уникальный биомаркер клеточных нарушений, связанных с неопластическими процессами в организме. Увеличение этого показателя свидетельствует о иммунопролиферативных расстройствах или злокачественных заболеваниях.
Обнаружение свободных цепей иммуноглобулинов или каппа-легких цепей является важным диагностическим критерием для различных заболеваний, а именно: множественная миелома; макроглобулинемия Вальденстрема; несекреторная миелома; моноклональная гаммапатия. Точное измерение моноклональных свободных легких цепей в сыворотке крови и /или моче важно для диагностики системного амилоидоза. На ранней стадии болезни каппа или лямбда-цепи присутствуют в количестве, превышающем физиологическую норму, поэтому могут быть сигналом к дополнительной диагностике. Каппа и гамма-цепи известны также под названием «белки Бенс-Джонса» и являются одними из самых первых официально описанных в медицинской литературе онкологических маркеров. Они были описаны еще в 1847 году и значительно облегчили медикам диагностику злокачественных новообразований.
источник
