Встречается в воздухе силосных башен и ям.
Применяется как растворитель и реагент в химической, текстильной и пищевой промышленности; при производстве линолеума, ацетилцеллюлозы, алкилацетатов.
Получается при сухой перегонке дерева (древесный уксус, содержащий 5— 7% уксусной кислоты, а также метиловый спирт, фенолы, нафталин и др.); при уксуснокислом брожении спиртовых жидкостей; каталитическим окислением ацетальдегида, этилового спирта; гидратацией кетена (может содержаться примесь дикетена); взаимодействием метанола с СО в присутствии катализаторов.
Физические свойства. Жидкость. Т. плавл. 16,7°, т. кип. 118,1°, плотн. 1,04 (20°/4°). Смешивается с водой.
Токсическое действие. Обладает сильным раздражающим действием. К парам наблюдается привыкание — по-видимому, лишь кажущееся. Высокие концентрации уксусной кислоты повышают содержание лимонной кислоты в тканях (Линючева).
Животные. Концентрация 2,5 мг/л (экспозиция 60 мин) вызывает у морских свинок раздражение верхних дыхательных путей и конъюнктивы; при 14 мг/л и той же экспозиции 50% животных погибает. На вскрытии — очаговый перибронхит, участки эмфиземы, мутное набухание клеток внутренних органов, в особенности печени (Ghiringelli, Di Fabio). При непрерывном вдыхании в течение 95 суток 0,005 и 0,0002 мг/л у белых крыс повышена активность холинэстеразы, изменяется белковый спектр крови, нарушаются соотношение хронаксии мышц-антагонистов, синтетическая функция печени, снижается гемолитическая устойчивость эритроцитов, содержание витамина С в печени, почках и надпочечниках (Тахиров; Тахиров, Халидов).
Человек. 2—3 мг/л переносимы не более 3 мин. Порог ощущения запаха — 0,0006 мг/л; порог рефлекторного изменения световой чувствительности глаза — на уровне 0,00048 мг/л, образования электрокортикального условного рефлекса — 0,00029 мг/л (Тахиров). Хроническое воздействие паров вызывает у рабочих сначала острые, а затем хронические риниты — как гипертрофические, так и атрофические, фарингиты, ларингиты, а также конъюнктивиты и бронхиты (Куприн). Концентрации, при которых наблюдались эти явления, близки к 0,1 мг/л. Хронический трахеобронхит и конъюнктивит были выявлены в производстве ацетилцеллюлозы при средней концентрации уксусной кислоты в воздухе 0,125 мг/л, а иногда до 0,38—0,44 мг/л (Ghiringelli, Di Fabio).
Сильнее действует древесный уксус — вследствие примесей, особенно метилового спирта, а также уксусная кислота, полученная через кетен, вследствие примеси дикетена. При приеме внутрь вызывает ожоги (язвы) пищевода, желудка.
Действие на кожу выражается в появлении ожогов, вызываемых уже 30% растворами кислоты. Древесный уксус может вызывать экземы. Заживление идет быстро. Для глаз опасны растворы уксусной кислоты, начиная с 2% концентрации (Каплан).
Всасывание уксусной кислоты из желудка весьма активно. Частично она превращается в организме в муравьиную кислоту.
Неотложная терапия. Обильное промывание водой пораженных мест, в том числе глаз (эффективнее, чем промывание питьевой содой).
Предельно допустимая концентрация 5 мг/м 3 [51].
Индивидуальная защита. Меры предупреждения. Фильтрующий промышленный противогаз марок А и В. Защита глаз и кожи. Устранение непосредственного контакта с уксусная кислота
Определение в воздухе. Используют иодометрический метод. Чувствительность 3 мг/м 3 [40].
Определение в моче и крови. Уксусную кислоту из мочи выделяют и определяют в виде метилацетата. Определение в крови — см. у Петрунькиной, в крови и тканях — [4].
источник
Уксусная кислота (CH3COOH) – это концентрированный уксус, знакомый человечеству с давних времён. Его изготовляли путём брожения вина, т.е. углеводов и спиртов.
По физическим свойствам уксусная кислота – бесцветная жидкость с кислым вкусом и резким запахом. Попадание жидкости на слизистые оболочки вызывает химический ожог. Уксусная кислота обладает гигроскопичностью, т.е. способна поглощать водяные пары. Хорошо растворима в воде.
Основные физические свойства уксуса:
- температура плавления – 16,75°C;
- плотность – 1,0492 г/см 3 ;
- температура кипения – 118,1°C;
- молярная масса – 60,05 г/моль;
- теплота сгорания – 876,1 кДж/моль.
В уксусе растворяются неорганические вещества и газы, например, бескислородные кислоты – HF, HCl, HBr.
Способы получения уксусной кислоты:
- из ацетальдегида путём окисления атмосферным кислородом в присутствии катализатора Mn(CH3COO)2 и высокой температуре (50-60°С) – 2CH3CHO + O2 → 2CH3COOH;
- из метанола и угарного газа в присутствии катализаторов (Rh или Ir) – CH3OH + CO → CH3COOH;
- из н-бутана путём окисления в присутствии катализатора при давлении 50 атм и температуре 200°C – 2CH3CH2CH2CH3 + 5O2 → 4CH3COOH + 2H2O.
Рис. 2. Графическая формула уксусной кислоты.
Уравнение брожения выглядит следующим образом – СН3СН2ОН + О2 → СН3СООН + Н2О. В качестве сырья используется сок или вино, кислород и ферменты бактерий или дрожжей.
Уксусная кислота проявляет слабые кислотные свойства. Основные реакции уксусной кислоты с различными веществами описаны в таблице.
Взаимодействие
Что образуется
С неметаллами (реакция замещения)
Органическая и неорганическая кислоты
– CH3COOH + Cl2 → CH2ClCOOH (хлоруксусная кислота) + HCl;
– CH3COOH + F2 → CH2FCOOH (фторуксусная кислота) + HF;
– CH3COOH + I2 → CH2ICOOH (иодуксусная кислота) + HI
С кислородом (реакция окисления)
Эфиры и соли, которые образует уксусная кислота, называются ацетатами.
Уксусная кислота широко применяется в различных отраслях:
- в фармацевтике – входит в состав лекарственных препаратов;
- в химической промышленности – используется для производства ацетона, красителей, ацетилцеллюлозы;
- в пищевой промышленности – применяется для консервации и вкуса;
- в лёгкой промышленности – используется для закрепления краски на ткани.
Уксусная кислота является пищевой добавкой под маркировкой Е260.
Рис. 3. Использование уксусной кислоты.
CH3COOH – уксусная кислота, получаемая из ацетальдегида, метанола, н-бутана. Это бесцветная жидкость с кислым вкусом и резким запахом. Из разбавленной уксусной кислоты производят уксус. Кислота обладает слабыми кислотными свойствами и реагирует с металлами, неметаллами, оксидами, основаниями, солями, кислородом. Уксусная кислота широко применяется в фармацевтике, пищевой, химической и лёгкой промышленности.
Средняя оценка: 4.2 . Всего получено оценок: 114.
Не понравилось? — Напиши в комментариях, чего не хватает.
- Неметаллы
- Химические свойства неметаллов
- Получение водорода
- Получение кислорода Химические свойства уксусной кислоты
- Аммиак
- Получение аммиака
- Окисление аммиака
- Фосфор
- Химические свойства фосфора
- Адсорбция
- Природные источники углеводородов
- Кристаллогидраты
- Круговорот азота в природе
- Круговорот углерода в природе
- Аллотропные модификации углерода
- Силикатная промышленность
- Сульфиды
- Сера
- Алкены
- Сероводород
- Озон
- Азот
- Раствор аммиака
- Кремний
- Оксид азота
- Химические свойства алканов
- Формула алканов
- Алканы
- Получение азотной кислоты
- Химические свойства кремния
- Соединения кремния
- Валентность кремния
- Непредельные углеводороды
- Предмет органической химии
- Азотная кислота
- Применение кислорода
- Химические свойства серной кислоты
показать все
По многочисленным просьбам теперь можно: сохранять все свои результаты, получать баллы и участвовать в общем рейтинге.
- 1.
Алина Сайбель 589
- 2.
Катя Будаева 226
- 3.
Константин Гавриков 223
- 4.
Ксюша Николаева 221
- 5.
Илья Сургутсков 179
- 6.
Лайла Жапарова 159
- 7.
Сулейман Гурдов 152
- 8.
Валерия Двинская 127
- 9.
‘taehyung ‘hypocrite’xxxxx’lideass 116
- 10.
Артём Фёдоров 101
- 1.
Мария Николаевна 11,605
- 2.
Лариса Самодурова 10,715
- 3.
Liza 10,580
- 4.
Кристина Волосочева 9,455
- 5.
TorkMen 9,406
- 6.
Ekaterina 9,396
- 7.
Вячеслав 9,330
- 8.
Лиса 9,210
- 9.
Влад Лубенков 9,195
- 10.
Юлия Бронникова 9,110
Самые активные участники недели:
- 1. Виктория Нойманн — подарочная карта книжного магазина на 500 рублей.
- 2. Bulat Sadykov — подарочная карта книжного магазина на 500 рублей.
- 3. Дарья Волкова — подарочная карта книжного магазина на 500 рублей.
Три счастливчика, которые прошли хотя бы 1 тест:
- 1. Наталья Старостина — подарочная карта книжного магазина на 500 рублей.
- 2. Николай З — подарочная карта книжного магазина на 500 рублей.
- 3. Давид Мельников — подарочная карта книжного магазина на 500 рублей.
Карты электронные(код), они будут отправлены в ближайшие дни сообщением Вконтакте или электронным письмом.
источник
Отравления уксусной кислотой достаточно часты, что обусловлено ее доступностью. Большая часть отравлений уксусной кислотой носит суицидальный характер.
Смертельная доза ледяной уксусной кислоты – 12 – 15 г, уксусной эссенции – 20 – 40 мл (10 – 20 г); столового уксуса – около 200 мл.
Поступление в организм уксусная кислота происходит в основном перорально, ингаляционно и через кожные покровы.
При местном контакте с кожей уксусная кислота с концентрацией более 30% способна вызывать ожоги и образование струпов. Местное действие уксусной кислоты слабее, чем у неорганических кислот.
Вдыхание паров уксусной кислоты приводит к раздражению слизистых оболочек верхних дыхательных путей, появлению кашля, затруднению дыхания, появлению болей в груди, тошноты, рвоты. Происходит развитие бронхопневмоний и воспаление глотки. Причиной смерти является асфиксия и тяжелые поражения легких.
Пероральное отравление уксусной кислотой характеризуется резкими болями в ротовой полости и по ходу пищеварительного тракта. Появляются ожоги слизистых ротовой полости, глотки, пищевода, желудка и кишечника, сопровождающиеся «кровавой» рвотой. Рвотные массы обладают характерным запахом.
Резорбтивное действие уксусной кислоты проявляется кислотным гемолизом (уксусная кислота относиться к гемолитическим ядам). Гемолиз сопровождается гемоглобинурией (выделение растворенного гемоглобина почками). Моча приобретает темно-красный цвет и содержит белок, развивается острая почечная недостаточность.
Нарушения со стороны ЦНС вызваны появлением возбуждения, слуховыми и зрительными галлюцинациями.
При паталогоанатомическом вскрытии наблюдаются ожоги слизистых ЖКТ, иногда перфорация стенок пищевода и желудка, острая дистрофия печени, нефроз, пневмония.
В организме уксусная кислота метаболизируется до ацетальдегида, превращающегося частично в этиловый спирт и частично разлагающегося с образованием CO2 и воды. Выводиться из организма через легкие, с мочой и калом, как в неизменном виде, так и в виде метаболитов. Следует отметить, что уксусная кислота является естественной составной частью организма человека, в обычных условиях присутствует в ряде внутренних органов и в небольших количествах выделяется с мочой и калом.
При приёме уксусной кислоты внутрь следует выпить большое количество жидкости. Вызов рвоты является крайне опасным, так как вторичное прохождение кислоты по пищеводу усугубит ожог. Показано промывание желудка через зонд. Необходима немедленная госпитализация.
Химико-токсикологическое исследование на наличие уксусной кислоты производится только при специальных заданиях или при наличии соответствующих указаний в материалах дела.
Объектами ХТА на отравление уксусной кислотой являются: легкие, печень; почки, желудок с содержимым.
Изолирование уксусной кислоты из биологического материалапроводят перегонкой с водяным паром объектов, предварительно подкисленных серной или фосфорной кислотой, собирая их в приемник с раствором гидроксида натрия (для избегания улетучивания уксусной кислоты). Такой способ извлечения подходит для исследования свежего биологического материала.
Полученный дистиллят делят на две части: одну часть исследуют качественными реакциями на наличие ацетат-ионов, а в другой, оттитровывая кислотой избыток гидроксида натрия, определяют количество уксусной кислоты.
Второй вариант извлечения уксусной кислоты – извлечение спиртом с последующим подщелачиванием полученного спиртового извлечения и выпариванием его на водяной бане. К полученному сухому остатку добавляют серную или фосфорную кислоты и подвергают перегонке с водяным паром. В этом случае уксусная кислота изолируется более чистой, но вместе с нею изолируются также ацетаты, растворимые в спирте.
Для проведения качественных реакций на ацетат-ионы часть дистиллята выпаривают на водяной бане досуха.
1. Реакция с хлоридом железа (III).
От прибавления железа (III) хлорида к ацетат-ионам появляется красная окраска, обусловленная образованием основного железа ацетата.
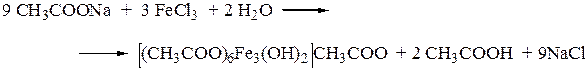
2. Реакция образования индиго.
При нагревании уксусной кислоты или ацетатов с солями кальция образуется ацетон, способный в присутствии щелочей взаимодействовать с о-нитробензальдегидом. Конечным продуктом реакции является индиго.
Реакция не специфична, ее способны давать вещества, гидролизующиеся с образованием ацетильной группы. Имеет судебно-химическое значение при отрицательном результате.
3. Образование этилацетата.
При нагревании ацетатов с этиловым спиртом в присутствии концентрированной cерной кислоты образуется уксусноэтиловый эфир (этилацетат), обнаруживаемый по характерному запаху, усиливающемуся при выливании реакционной смеси в холодную воду:
Реакция характерна для ацетат-ионов, однако ощущение запаха является субъективным.
4. Образование окиси какодила.
Ацетат кальция, образующийся при взаимодействии уксусной кислоты с солями кальция, при нагревании с сухим мышьяковистым ангидридом или солью, мышьяковистой кислоты дает окись какодила, имеющую неприятный запах.
Чувствительность реакции 5-10 мг в 1 мл дистиллята.
Дата добавления: 2015-08-17 ; просмотров: 3095 . Нарушение авторских прав
источник
Это один из базовых продуктов, получаемых в процессе промышленного органического синтеза. Уксусная кислота не имеет цвета, но отличается специфическим запахом и вкусом, ее получение осуществляется посредством окисления определенного альдегида; из-за своих химических свойств, она способна причинить существенный вред человеку, поэтому жидкость используется лишь в форме водных растворов. Более половины произведенного продукта тратится на изготовление полимеров, а также производных винилацетата и целлюлозы.
Это синтетический продукт, образованный путем брожения этанола и углеводов или после естественного скисания сухих винных сортов. Этановая кислота принимает участие в обменных процессах, осуществляющихся в организме человека. Кислую жидкость, кроме того, используют для приготовления консервации, маринадов. Определенные свойства продукта делают его незаменимым во множестве химических соединений, средствах бытового значения.
В состав уксусной кислоты входит уксус 3-9% уксус и 70-80% уксусная эссенция. Соли и эфиры продукта называются ацетатами. Обычный уксус, который используется в кулинарии, содержит яблочную, аскорбиновую, уксусную и молочную кислоты. Ежегодно в мире производят около 5 миллионов тонн этановая кислоты. Ее химическая формула имеет следующий вид: C2H4O2.
Из чего делают уксусную кислоту сегодня? Для получения жидкости технического назначения используется древесный черный порошок, который содержит большое количество смолистых веществ. Самым выгодным химическим способом получения продукта является окисления этаналя или ацетальдегида, который в промышленности получают либо посредством гидратации ацетилена с солями ртути (метод называют реакцией Чугаева) или же окислением этилового спирта над раскаленной медью. Ацетальдегид самостоятельно окисляется кислородом и трансформируется в уксусную кислоту.
Раствор уксусной кислоты транспортируется на разные расстояния в автомобильных или железнодорожных цистернах, произведенных из специальных видов нержавеющих стальных материалов. На складах жидкость хранится в герметичных контейнерах, емкостях, бочках под навесами либо в специальных помещениях. Заливать и хранить кислоту в полимерной таре допускается максимум на протяжении одного месяца.
Растворы уксусной кислоты, которые применяются пищевой промышленностью, бытовой кулинарии, консервации, называются уксусом и уксусной эссенцией. Абсолютная концентрированная кислота называется ледяной, поскольку при замерзании она преобразуется в массу, напоминающую по структуре лед. Разная концентрация уксусной кислоты обуславливает следующую классификацию продукта:
- эссенция (содержит 30-80% кислоты, является компонентом медикаментов от зуда, грибков);
- ледяная (раствор 96%, используется для удаления мозолей, бородавок);
- столовый уксус (имеет концентрацию 3, 6 или 9%, активно используется для бытовых целей);
- ацетатное вещество (эфир кислоты);
- натуральный яблочный уксус (имеет низкий кислотный процент, применяется косметологами, кулинарами);
- бальзамический уксус (настоянный на определенных пряных растениях столовый продукт).
Прозрачная жидкость обладает резким запахом, имеет плотность 1,05 г/см2. Физические свойства уксусной кислоты обуславливают ее замерзание при температуре 16,6 градусов, при этом субстанция приобретает вид прозрачных кристаллов, напоминающих лед (из-за этого концентрированную кислую жидкость называют ледяной). Кислота имеет способность активно поглощать влагу из воздуха, она может нейтрализовать основные окислы и гидраты, и, кроме того, вытеснять из углекислых солей углекислоту.
Уксусный продукт причислен к веществам с третьим классом опасности из-за своей воспламеняемости и опасного воздействия на организм. При любых работах с субстанцией специалисты используют современные средства защиты (противогазы). Даже добавка в пищу Е-260 может быть токсичной для организма, однако степень ее воздействия зависит от концентрации и качества продукта. Опасное влияние уксуса на организм возможно при кислотности выше 30%. Если концентрированная субстанция будет взаимодействовать с кожей/слизистым оболочками, на теле проявятся сильные химические ожоги.
При разумном использовании средства, уксус поможет устранить многие заболевания и косметические дефекты. Так, уксусный продукт применяется для терапии простуды и ревматизма в качестве препарата для растирания. Кислая жидкость, кроме того, оказывает бактерицидный эффект: натуральный антисептик помогает уничтожить грибки и прочую патогенную флору при ангине, фарингите, молочнице. Полезен уксус для волос, поскольку является отличным средством против перхоти. Для кожи жидкость используют при косметических обертываниях и как средство против зуда после укуса насекомых.
Воздействие уксусного продукта на организм человека напоминает влияние азотной, серной или соляной кислот, при этом главное отличие состоит в поверхностной воздействие уксуса. Смертельной для человека дозой продукта является 12 мл: это количества равно примерно стакану столового уксуса или 20-40 мл эссенции. Уксусные пары при попадании в легкие становятся причиной развития пневмонии с осложнениями. Другие симптомы передозировки – это:
- геморрагия печени;
- некроз тканей;
- ожог внутренних органов;
- изъязвление органов ЖКТ;
- нефроз с сопутствующим отмиранием почечных клеток.
Кислая жидкость широко применяется в разнообразных сферах. Она незаменима для фармакологии, поскольку служит компонентом аспирина, фенацетина и других лекарственных препаратов. Во время нитрования ароматические амины NH2-группы защищаются путем введения ацетильной группы СН3СО – это тоже распространенная реакция, в которой участвует уксус. Важную роль продукт играет при производстве ацетона, ацетилцеллюлозы, разных синтетических красителей.
Без продукта не обходится изготовление различной парфюмерии и негорючих типов пленок. Часто кислую жидкость используют в пищевой промышленности, в роли добавки Е-260. При этом без уксуса не обходится бытовая кулинария и консервирование. При окрашивании основные виды солей кислоты выполняют функцию специальных протрав, обеспечивая крепкую связь текстильных волокон с красителем. Уксусные соли часто используются для ликвидации самых стойких растений-вредителей.
В фармакологии и медицинской сфере жидкость применяется как основа лекарственных средств, к примеру ацетилсалициловой кислоты (аспирина). Кроме того, из нее получают уксуснокислые соли свинца и алюминия, которые выполняют роль вяжущих средств и используются для лечения воспалительных процессов разной этимологии. Уксус оказывает жаропонижающее, противовоспалительное, болеутоляющее действие, поэтому он используется при головной боли, лихорадке, невралгии и пр.
Кислая субстанция часто комбинируется с другими лекарственными средствами в народной медицине для лечения множества патологий – полиартрита, лишаев, ревматизма, педикулеза, алкогольного отравления, бородавок, радикулита, пр. Примеры применения продукта:
- Обтирание при высокой температуре. Лучше использовать рисовый, яблочный или винный натуральный уксус, но можно взять и обычный столовый (6 или 9%). На 0,5 л теплой воды следует добавить 1 ст. л. уксуса, перемешать состав, после чего использовать для растираний.
- Средство от атеросклероза. Из 4 головок чеснока и 5 лимонов нужно выжать сок, смешать компоненты с 0,5 л меда и 50 мл уксуса (яблочного). Принимать состав нужно по 1 ст. л., смешав с ½ ст. воды, трижды за сутки. Курс терапии составляет 3 месяца.
источник

Уксусная кислота – это органический продукт со специфическим запахом и вкусом, представляет собой результат брожения спиртовых и углеводных компонентов либо скисания вин.
Это вещество в форме винного уксуса было известно еще в Древней Греции и Древнем Риме. В более поздние времена алхимики научились производить более чистую субстанцию в результате перегонки. Кислота в виде кристаллов была выведена в 1700 году. Приблизительно в это же время химики определили ее формулу и заприметили способность вещества к воспламенению.
В природе уксусная кислота редко встречается в свободном виде. В составе растений она представлена в форме солей или эфиров, в теле животных найдена в составе мышечной ткани, селезенки, а также в моче, поте, экскрементах. Легко образуется вследствие брожения, гниения, в процессе распада сложных органических соединений.
Синтетическую форму уксусной кислоты получают после реакции воздействия углекислотой на натрий-метил либо же при воздействии на метилат натрия, нагретый до 160 градусов, окисью углерода. Есть и другие способы создания этой субстанции в лаборатории.
Чистая уксусная кислота – это прозрачная жидкость с удушливым запахом, вызывающая ожоги на теле. Если зажечь пары вещества, они дадут светло-голубое пламя. Растворяясь в воде, кислота выделяет тепло.
Ацетилкофермент А образовывается при участии уксусной кислоты, которая также необходима для биосинтеза стеринов, жирных кислот, стероидов и других веществ. Химические свойства уксусной кислоты делают ее незаменимой во многих процессах и реакциях. Уксусная кислота помогает образовывать соли, амиды, сложные эфиры.
Но помимо полезных свойств, является опасным, легковоспламеняющимся веществом. Поэтому работая с ним, необходимо максимально соблюдать технику безопасности, избегая прямого контакта с кожей, стараясь не дышать кислотными парами.
- ледяная (96-процентный раствор, применяют для удаления бородавок, мозолей);
- эссенция (содержит 30-80 процентов кислоты, входит в состав медпрепаратов против грибков и зуда);
- уксус столовый (3-, 6-, 9-процентный раствор, активно применяется в быту);
- яблочный (или другой фруктово-ягодный) уксус (с низким процентом кислотности, применяется в кулинарии, косметологии);
- уксус бальзамический, или ароматный (столовый уксус, настоянный на пряных растениях, применяется в кулинарии и косметологии);
- ацетат (эфир кислоты).
Уксусная кислота в чистом виде – вещество весьма агрессивное и может принести вред здоровью.
Поэтому в быту используется ее водный раствор (разной концентрации). Существуют два способа создания уксуса:
Продукт промышленной деятельности может содержать в себе 3, 6 или 9 процентов уксусной кислоты. Насыщенность домашнего уксуса еще ниже, что делает его безопаснее для потребления. Помимо низкой концентрации, продукт домашнего производства содержит в себе много витаминов и других полезных веществ. Спектр нутриентов зависит от продукта, из которого был изготовлен уксус. Наиболее часто применяют яблочное и виноградное сырье. Существует еще так называемый бальзамический уксус, сделанный из столового с добавлением пряных трав.
Говорить о суточной норме потребления уксусной кислоты не приходится. Несмотря на высокую популярность уксуса в быту, широкое применение в кулинарии, ученые так и не рассчитали, сколько этого вещества можно или нужно потреблять человеку. Правда, и современная медицина не знает случаев, когда бы у кого-либо возникли проблемы со здоровьем через недостаточное потребление этого продукта.

Помимо этой очевидной причины для отказа от уксуса, существует еще одна. У некоторых людей встречается индивидуальная непереносимость вещества. Во избежание неприятных последствий, таким лицам также не следует потреблять пищу, приправленную уксусом.
Воздействие уксусной кислоты на человеческий организм значительной мерой напоминает влияние соляной, серной или азотной кислот. Отличие – в более поверхностном воздействии уксуса.
Примерно 12 мл чистой уксусной кислоты является смертельной для человека. Эта порция аналогична примерно стакану столового уксуса или 20-40 мл уксусной эссенции. Пары вещества, попадая в легкие, вызывают пневмонию с усложнениями. Среди других возможных последствий передозировки – некроз тканей, геморрагия печени, нефроз с отмиранием почечных клеток.
Уксусная кислота превосходно взаимодействует с протеинами. В частности, в комбинации с уксусом белки из пищи более легко усваиваются организмом. Аналогично кислый водный раствор воздействует на углеводы, делая их более легкими для переваривания. Эта биохимическая способность делает продукт «правильным» соседом для мясной, рыбной или овощной пищи. Но опять-таки это правило работает только при условии здоровой пищеварительной системы.
Альтернативная медицина применяет уксусную кислоту, а точнее ее водный раствор, в качестве лекарства от многих болезней.
Пожалуй, наиболее известный и потребляемый прием – снижение высокой температуры с помощью уксусных компрессов. Не менее известное применение этой жидкости при укусах комаров, пчел и других насекомых, эффективен для избавления от педикулеза. С помощью водного раствора кислоты народные целители лечат ангины, фарингиты, артрит, ревматизм, а также грибок стоп и молочницу. Для уменьшения симптомов простуды в комнате, где лежит больной, распыляют уксус. А если участок кожи, обгоревший под солнцем или обожженный медузой, помазать кислым раствором, получится уменьшить неприятные симптомы.

Также он важен для снижения холестерина, стабилизации сахара в крови (у диабетиков), избавления от лишнего веса (за счет ускорения метаболизма). Камни в почках альтернативная медицина также выводит уксусной кислотой из яблок.
В косметологии уксусная кислота пребывает в особом почете. Об эффективности этого вещества в борьбе с целлюлитом и лишними сантиметрами рассказывают весьма вдохновляющие истории. Курс обертываний с использованием уксуса – и можно забыть об «апельсиновой корке». Так, по крайней мере, гласят отзывы на форумах худеющих женщин.
Также известно применение уксусной кислоты для лечения от перхоти и прыщей. Результат достигается благодаря антибактериальным способностям вещества. Вернуть волосам блеск и силу также по силам уксусу. Достаточно после каждого мытья ополаскивать чистые кудри легким кислотным раствором. А защитить от облысения поможет уксус с корнем аира и листьями крапивы.
Уксусная кислота – компонент с широким спектром применения. В частности, в фармацевтическ токсичной для человека.
Также это вещество – важный компонент в парфюмерии. Соли уксусной кислоты используются в качестве протрав и как средство против сорняков.
Первым и наиболее концентрированным источником кислоты, являются разного вида уксусы: яблочный, винный, столовый и другие.
Также это вещество содержится в меде, винограде, яблоках, финиках, инжире, свекле, арбузе, бананах, солоде, пшенице и других продуктах.
Уксусная кислота – субстанция весьма противоречивая. При правильном использовании она может послужить в пользу для человека. Если же забыть о технике безопасности, о том, что уксус – это опасная кислота, разведенная водой, проблем не обобраться. Но теперь вы знаете, как с пользой для здоровья применять вещество с формулой СН3СООН и чем оно полезно людям.
источник

Уксусная кислота – это органический продукт со специфическим запахом и вкусом, представляет собой результат брожения спиртовых и углеводных компонентов либо скисания вин.
Это вещество в форме винного уксуса было известно еще в Древней Греции и Древнем Риме. В более поздние времена алхимики научились производить более чистую субстанцию в результате перегонки. Кислота в виде кристаллов была выведена в 1700 году. Приблизительно в это же время химики определили ее формулу и заприметили способность вещества к воспламенению.
В природе уксусная кислота редко встречается в свободном виде. В составе растений она представлена в форме солей или эфиров, в теле животных найдена в составе мышечной ткани, селезенки, а также в моче, поте, экскрементах. Легко образуется вследствие брожения, гниения, в процессе распада сложных органических соединений.
Синтетическую форму уксусной кислоты получают после реакции воздействия углекислотой на натрий-метил либо же при воздействии на метилат натрия, нагретый до 160 градусов, окисью углерода. Есть и другие способы создания этой субстанции в лаборатории.
Чистая уксусная кислота – это прозрачная жидкость с удушливым запахом, вызывающая ожоги на теле. Если зажечь пары вещества, они дадут светло-голубое пламя. Растворяясь в воде, кислота выделяет тепло.
Ацетилкофермент А образовывается при участии уксусной кислоты, которая также необходима для биосинтеза стеринов, жирных кислот, стероидов и других веществ. Химические свойства уксусной кислоты делают ее незаменимой во многих процессах и реакциях. Уксусная кислота помогает образовывать соли, амиды, сложные эфиры.
Но помимо полезных свойств, является опасным, легковоспламеняющимся веществом. Поэтому работая с ним, необходимо максимально соблюдать технику безопасности, избегая прямого контакта с кожей, стараясь не дышать кислотными парами.
- ледяная (96-процентный раствор, применяют для удаления бородавок, мозолей);
- эссенция (содержит 30-80 процентов кислоты, входит в состав медпрепаратов против грибков и зуда);
- уксус столовый (3-, 6-, 9-процентный раствор, активно применяется в быту);
- яблочный (или другой фруктово-ягодный) уксус (с низким процентом кислотности, применяется в кулинарии, косметологии);
- уксус бальзамический, или ароматный (столовый уксус, настоянный на пряных растениях, применяется в кулинарии и косметологии);
- ацетат (эфир кислоты).
Уксусная кислота в чистом виде – вещество весьма агрессивное и может принести вред здоровью.
Поэтому в быту используется ее водный раствор (разной концентрации). Существуют два способа создания уксуса:
Продукт промышленной деятельности может содержать в себе 3, 6 или 9 процентов уксусной кислоты. Насыщенность домашнего уксуса еще ниже, что делает его безопаснее для потребления. Помимо низкой концентрации, продукт домашнего производства содержит в себе много витаминов и других полезных веществ. Спектр нутриентов зависит от продукта, из которого был изготовлен уксус. Наиболее часто применяют яблочное и виноградное сырье. Существует еще так называемый бальзамический уксус, сделанный из столового с добавлением пряных трав.
Говорить о суточной норме потребления уксусной кислоты не приходится. Несмотря на высокую популярность уксуса в быту, широкое применение в кулинарии, ученые так и не рассчитали, сколько этого вещества можно или нужно потреблять человеку. Правда, и современная медицина не знает случаев, когда бы у кого-либо возникли проблемы со здоровьем через недостаточное потребление этого продукта.

Помимо этой очевидной причины для отказа от уксуса, существует еще одна. У некоторых людей встречается индивидуальная непереносимость вещества. Во избежание неприятных последствий, таким лицам также не следует потреблять пищу, приправленную уксусом.
Воздействие уксусной кислоты на человеческий организм значительной мерой напоминает влияние соляной, серной или азотной кислот. Отличие – в более поверхностном воздействии уксуса.
Примерно 12 мл чистой уксусной кислоты является смертельной для человека. Эта порция аналогична примерно стакану столового уксуса или 20-40 мл уксусной эссенции. Пары вещества, попадая в легкие, вызывают пневмонию с усложнениями. Среди других возможных последствий передозировки – некроз тканей, геморрагия печени, нефроз с отмиранием почечных клеток.
Уксусная кислота превосходно взаимодействует с протеинами. В частности, в комбинации с уксусом белки из пищи более легко усваиваются организмом. Аналогично кислый водный раствор воздействует на углеводы, делая их более легкими для переваривания. Эта биохимическая способность делает продукт «правильным» соседом для мясной, рыбной или овощной пищи. Но опять-таки это правило работает только при условии здоровой пищеварительной системы.
Альтернативная медицина применяет уксусную кислоту, а точнее ее водный раствор, в качестве лекарства от многих болезней.
Пожалуй, наиболее известный и потребляемый прием – снижение высокой температуры с помощью уксусных компрессов. Не менее известное применение этой жидкости при укусах комаров, пчел и других насекомых, эффективен для избавления от педикулеза. С помощью водного раствора кислоты народные целители лечат ангины, фарингиты, артрит, ревматизм, а также грибок стоп и молочницу. Для уменьшения симптомов простуды в комнате, где лежит больной, распыляют уксус. А если участок кожи, обгоревший под солнцем или обожженный медузой, помазать кислым раствором, получится уменьшить неприятные симптомы.

Также он важен для снижения холестерина, стабилизации сахара в крови (у диабетиков), избавления от лишнего веса (за счет ускорения метаболизма). Камни в почках альтернативная медицина также выводит уксусной кислотой из яблок.
В косметологии уксусная кислота пребывает в особом почете. Об эффективности этого вещества в борьбе с целлюлитом и лишними сантиметрами рассказывают весьма вдохновляющие истории. Курс обертываний с использованием уксуса – и можно забыть об «апельсиновой корке». Так, по крайней мере, гласят отзывы на форумах худеющих женщин.
Также известно применение уксусной кислоты для лечения от перхоти и прыщей. Результат достигается благодаря антибактериальным способностям вещества. Вернуть волосам блеск и силу также по силам уксусу. Достаточно после каждого мытья ополаскивать чистые кудри легким кислотным раствором. А защитить от облысения поможет уксус с корнем аира и листьями крапивы.
Уксусная кислота – компонент с широким спектром применения. В частности, в фармацевтическ токсичной для человека.
Также это вещество – важный компонент в парфюмерии. Соли уксусной кислоты используются в качестве протрав и как средство против сорняков.
Первым и наиболее концентрированным источником кислоты, являются разного вида уксусы: яблочный, винный, столовый и другие.
Также это вещество содержится в меде, винограде, яблоках, финиках, инжире, свекле, арбузе, бананах, солоде, пшенице и других продуктах.
Уксусная кислота – субстанция весьма противоречивая. При правильном использовании она может послужить в пользу для человека. Если же забыть о технике безопасности, о том, что уксус – это опасная кислота, разведенная водой, проблем не обобраться. Но теперь вы знаете, как с пользой для здоровья применять вещество с формулой СН3СООН и чем оно полезно людям.
источник
Этановая кислота больше известна как уксусная. Она представляет собой органическое соединение с формулой CH3COOH. Относится к классу карбоновых кислот, молекулы которых содержат функциональные одновалентные карбоксильные группы COOH (либо одну, либо несколько). О ней можно представить много информации, но сейчас вниманием стоит отметить лишь самые интересные факты.
Как она выглядит, можно понять по приложенному ниже изображению. Химическая формула уксусной кислоты несложная. Это обуславливается многим: само соединение является одноосновным, да и относится оно к карбоксильной группе, для которой характерно легкое отщепление протонов (стабильная элементарная частица). Данное соединение – типичный представитель карбоновых кислот, поскольку оно обладает всеми их свойствами.
Связь между кислородом и водородом (−COOH) — сильнополярная. Это обуславливает легкий процесс диссоциации (растворения, распада) данных соединений и проявление их кислотных свойств.
В итоге образуется протон H + и ацетат-ион CH3COO − . Что представляют собой эти вещества? Ацетат-ион – это лиганд, связанный с определенным акцептором (объектом, получающим что-то от донорского соединения), образующий устойчивые ацетатные комплексы с катионами многих металлов. А протон – это, как уже говорилось выше, частица, способная захватывать электрон с электронной М-, К- или L- оболочками атома.
Он основан именно на диссоциации уксусной кислоты. Качественный анализ, также называемый реакцией, представляет собой совокупность физических и химических методов, которые применяются для обнаружения соединений, радикалов (независимые молекулы и атомы) и элементов (совокупности частиц), которые входят в состав анализируемого вещества.
С помощью данного способа удается обнаружить соли уксусной кислоты. Выглядит все не так сложно, как может казаться. В раствор добавляют сильную кислоту. серную, например. И если появляется запах уксусной кислоты, то ее соль в растворе присутствует. Как это работает? Остатки уксусной кислоты, которые образуются из соли, связываются в тот момент с катионами водорода от серной. Каков результат? Появление большего количества молекул уксусной кислоты. Диссоциация так и происходит.
Следует отметить, что обсуждаемое соединение способно взаимодействовать с активными металлами. К таковым относится литий, натрий, калий, рубидий, франций, магний, цезий. Последний, кстати, является наиболее активным. Что происходит в момент таких реакций? Выделяется водород, и происходит образование пресловутых ацетатов. Вот как выглядит химическая формула уксусной кислоты, вступившей в реакцию с магнием: Mg + 2СН3СООН → (СН3СОО)2Mg + Н2↑.
Есть способы получения дихлоруксусной (CHCl2COOH) и трихлоруксусной (CCl3COOH) кислот. В них атомы водорода метильной группы замещены хлорными. Способа их получения всего два. Один заключается в гидролизе трихлорэтилена. И он менее распространен, чем другой, основанный на способности уксусной кислоты хлорироваться действием газообразного хлора. Данный метод проще и эффективней.
Вот как этот процесс выглядит в виде химической формулы уксусной кислоты, взаимодействующей с хлором: СН3СООН + Cl2 → СН2CLCOOH + HCL. Только стоит уточнить один момент: так получается просто хлоруксусная кислота, две вышеупомянутые образуются с участием красного фосфора в небольших количествах.
Стоит отметить, что уксусная кислота (CH3COOH) способна вступать во все реакции, которые являются характерными для пресловутой карбоновой группы. Ее можно восстановить до этанола, одноатомного спирта. Для этого необходимо воздействовать на нее алюмогидридом лития – неорганическим соединением, которое является мощным восстановителем, часто применяемым в органическом синтезе. Его формула – Li(AlH4).
Также уксусную кислоту можно превратить в хлорангидрид – активный ацилирующий агент. Происходит это под воздействием тионилхлорида. Он, кстати, является хлорангидридом сернистой кислоты. Ее формула – H2SO3. Стоит еще отметить, что натриевая соль уксусной кислоты при нагревании со щелочью декарбоксилируется (молекула диоксида углерода исключается), в результате чего образуется метан (CH₄). А он, как известно, представляет собой простейший углеводород, являющийся легче воздуха.
Ледяная уксусная кислота – нередко рассматриваемое соединение называют именно так. Дело в том, что она при охлаждении всего до 15-16 °C переходит в кристаллическое состояние, как будто бы замерзает. Визуально это действительно очень похоже на лед. При наличии нескольких ингредиентов можно провести эксперимент, результатом которого станет превращение уксусной кислоты в ледяную. Все просто. Из воды и льда нужно приготовить охлаждающую смесь, а потом опустить в нее подготовленную заранее пробирку с уксусной кислотой. Через несколько минут она кристаллизуется. Кроме соединения, для этого нужен химический стакан, штатив, термометр и пробирка.
Уксусная кислота, химическая формула и свойства которой были перечислены выше, является небезопасной. Ее пары оказывают раздражающее действие на слизистые оболочки верхних дыхательных путей. Порог для восприятия запаха этого соединения, находящегося в воздухе, находится в районе 0,4 мг/л. Но есть еще понятие предельно допустимой концентрации – санитарно-гигиенический норматив, утвержденный в законодательном порядке. Согласно ему, в воздухе может находиться до 0,06 мг/м³ этого вещества. А если речь идет о рабочих помещениях, то предел возрастает до 5 мг/м 3 .
Губительность действия кислоты на биологические ткани напрямую зависит от того, как сильно она разбавлена водой. Наиболее опасны растворы с содержанием этого вещества более 30 %. А если человек случайно вступит в контакт с концентрированным соединением, то ему не удастся избежать химических ожогов. Этого категорически нельзя допустить, поскольку после этого начинают развиваться коагуляционные некрозы – отмирание биологических тканей. Смертельная доза составляет всего 20 мл.
Логично, что чем выше концентрация уксусной кислоты, тем больший вред она окажет в случае попадания ее на кожу или внутрь организма. К общим симптомам отравления относят:
- Ацидоз. Кислотно-щелочной баланс смещается в сторону увеличения кислотности.
- Сгущение крови и нарушение ее свертываемости.
- Гемолиз эритроцитов, их разрушение.
- Поражение печени.
- Гемоглобинурия. В моче появляется гемоглобин.
- Острая почечная недостаточность.
- Токсический ожоговый шок.
- Легкая. Характеризуется небольшими ожогами пищевода и ротовой полости. Но сгущение крови отсутствует, а внутренние органы продолжают функционировать нормально.
- Средняя. Наблюдается интоксикация, шок и сгущение крови. Желудок поражен.
- Тяжелая. Сильно страдают верхние дыхательные пути, стенки пищеварительного тракта, развивается почечная недостаточность. Болевой шок максимальный. Возможно развитие ожоговой болезни.
Отравление парами уксусной кислоты тоже возможно. Оно сопровождается сильным насморком, кашлем и слезотечением.
Если человек отравился уксусной кислотой, то очень важно быстро действовать для минимизирования последствий от случившегося. Рассмотрим, что надо делать:
- Прополоскать ротовую полость. Воду не проглатывать.
- Сделать зондовое промывание желудка. Потребуется 8-10 литров холодной воды. Даже кровяные примеси – не противопоказание. Потому что в первые часы отравления большие сосуды еще остаются целыми. Так что опасного кровотечения не будет. Перед промыванием нужно сделать обезболивание анальгетиками. Зонд смазывается вазелиновым маслом.
- Рвоту не вызывать! Нейтрализовать вещество можно жженой магнезией или препаратом «Альмагель».
- Нет ничего из перечисленного? Тогда пострадавшему дают лед и подсолнечное масло – надо сделать несколько глотков.
- Допустимо употребление пострадавшим смеси из молока и яиц.
Важно оказать первую помощь в течение двух часов после случившегося. По истечении данного срока слизистые оболочки сильно отекают, и уже уменьшить боль человека будет сложно. И да, ни в коем случае нельзя использовать соду. Сочетание кислоты и щелочи даст реакцию, в ходе которой выработается углекислый газ и вода. А такое образование внутри желудка может привести к летальному исходу.
Водные растворы этановой кислоты широко используются в пищевой промышленности. Это уксусы. Для их получения кислоту разводят водой, чтобы получился 3-15-процентный раствор. Как добавка они обозначаются маркировкой Е260. Уксусы входят в состав различных соусов, а еще их используют для консервирования продуктов, маринования мяса и рыбы. В быту они широко применимы для удаления накипи, пятен с одежды и посуды. Уксус – прекрасный дезинфектор. Им можно обработать любую поверхность. Иногда его добавляют при стирке, чтобы смягчить одежду.
Также уксус применим в получении душистых веществ, лекарственных средств, растворителей, в производстве ацетона и ацетилцеллюлозы, например. Да, и в крашении и книгопечатании уксусная кислота принимает непосредственное участие.
Кроме всего, ее используют как реакционную среду для проведения окисления самых разных органических веществ. Примером из промышленности можно считать окисление параксилола (углеводород ароматического ряда) кислородом воздуха в терефталевую ароматическую кислоту. Кстати, так как пары этого вещества имеют резкий раздражающий запах, его можно использовать как замену нашатырного спирта для выведения человека из обморочного состояния.
Это легковоспламеняющаяся жидкость, которая относится к веществам третьего класса опасности. Она используется в промышленности. При работе с ней применяются индивидуальные средства защиты. Хранят это вещество в особых условиях и только в определенной таре. Как правило, это:
- чистые железнодорожные цистерны;
- контейнеры;
- автоцистерны, бочки, емкости из нержавеющей стали (вместимость до 275 дм 3 );
- стеклянные бутыли;
- полиэтиленовые бочки вместимостью до 50 дм 3 ;
- герметичные резервуары из нержавеющей стали.
Если жидкость хранят в полимерной таре, то это как максимум месяц. Также категорически не допускается совместное хранение данного вещества с такими сильными окислителями, как перманганат калия, серная и азотная кислоты.
О нем тоже стоит сказать пару слов. В состав традиционного, всем привычного уксуса входят следующие кислоты:
- Яблочная. Формула: НООССН₂СН(ОН)СООН. Является распространенной пищевой добавкой (Е296) природного происхождения. Содержится в незрелых яблоках, малине, рябине, барбарисе и винограде. В табаке и махорке представлена в виде солей никотина.
- Молочная. Формула: CH₃CH(OH)COOH. Формируется при распаде глюкозы. Пищевая добавка (Е270), которую получают молочнокислым брожением.
- Аскорбиновая. Формула: C₆H₈O₆. Пищевая добавка (Е300), применяемая как антиоксидант, предотвращающий окисление продукта.
И конечно же, этановое соединение в состав уксуса тоже входит – это основа данного продукта.
Это часто задаваемый вопрос. Все видели в продаже уксусную кислоту 70 %. Ее покупают, чтобы готовить смеси для народного лечения, или для использования в качестве приправы, маринада, добавки в соус или закатку. Но нельзя применять такой мощный концентрат. Поэтому появляется вопрос о том, как развести до уксуса уксусную кислоту. Для начала нужно себя обезопасить – надеть перчатки. Затем следует подготовить чистую воду. Для растворов различных концентраций понадобится определенное количество жидкости. Какое? Что ж, смотрим на приведенную ниже таблицу и разводим уксусную кислоту с учетом данных.
Начальная концентрация уксуса 70 %
1:1,5 (соотношение – одна часть уксуса на энную часть воды)
источник
Уксусная кислота (англ. acetic ac > Оглавление (общее для обеих частей)
источник
 Алина Сайбель 589
Алина Сайбель 589